
已知1~18号元素的离子aW3+、bX+、cY2-、dZ - 都具有相同的电子层结构,下列关系正确的是
A.离子的还原性:Y2->Z- B.质子数:c>b
C.氢化物的稳定性:H2Y>HZ D.原子半径:X<W
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
工业上制备纯硅反应的热化学方程式如下:
SiCl4 (g)+2H2 (g)=Si (s)+4HCl (g) 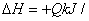 mol(Q>0)
mol(Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L, 则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
右图为周期表的一小部分,A、B、C、D、E的位置关系如图所示。其中B元素的最高正价是最低负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题:
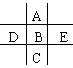 (1) 写出B、D、E最高氧化物对应水化物的化学式:_______、_______、_______。其中酸性最强的是
(1) 写出B、D、E最高氧化物对应水化物的化学式:_______、_______、_______。其中酸性最强的是
(2)写出A、B、C所形成气态氢化物的化学式: 、 、 。其中最稳定的是 。
(3)D和E组成的一种化合物,化合物中各原子最外层都满足8电子结构,这种化合物的电子式是 。
(4)写E的单质与B的氢化物反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学——物质结构与性质】
H、C、N、O、都属于自然界中常见非金属元素。
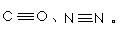 (1)O、C、N三种元素的第一电离能由小到大顺序是 ;NH4+中氮原子轨道的杂化类型为________。
(1)O、C、N三种元素的第一电离能由小到大顺序是 ;NH4+中氮原子轨道的杂化类型为________。
(2)CO、N2的结构可表示为: 两者的键能数据:(单位kJ/mol)
| A—B | A=B |
| |
| CO | 357.7 | 798.9 | 1071.9 |
| N2 | 154.8 | 418.4 | 941.7 |
 结合数据说明CO比N2活泼的原因 。
结合数据说明CO比N2活泼的原因 。
(3)乙二胺(H2N-CH2-CH2-NH2)和三甲胺[N(CH3)3]均属
于胺,但乙二胺比三甲胺的沸点高的多,原因是
。
(4)C、N元素形成的新材料具有如右图所示结构,该晶体
硬度将超过目前世界上最硬的金刚石,成为首屈一指
的超硬新材料。该物质的化学式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
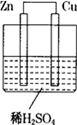
一个原电池的总反应的离子方程式是Zn+Cu2+=Zn2++Cu,该反应的原电池的组成正确的是
| A | B | C | D | |
| 正极 | Zn | Ag | Cu | Cu |
| 负极 | Cu | Cu | Zn | Zn |
| 电解质溶液 | CuCl2 | H2S04 | CuSO4 | FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
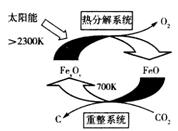 (1)科学家提出由CO2制取C的太阳能工艺如右图所示。
(1)科学家提出由CO2制取C的太阳能工艺如右图所示。
①若“重整系统”发生的反应中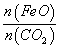 =6,则FexOy的化学式为______________。
=6,则FexOy的化学式为______________。
②“热分解系统”中每分解l mol FexOy,转移电子的物质的量为________。
(2)工业上用CO2和H2反应合成二甲醚。已知:
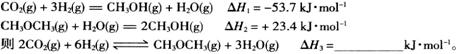
①一定条件下,上述合成二甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是_____(填代号)。
a.逆反应速率先增大后减小
 b.H2的转化率增大
b.H2的转化率增大
c.反应物的体积百分含量减小
d.容器中的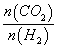 值变小
值变小
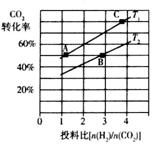
②在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的转化率如右图所示。
T1温度下,将6 mol CO2和12 mol H2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率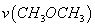 =______;KA、KB、KC三者之间的大小关系为______________。
=______;KA、KB、KC三者之间的大小关系为______________。
(3)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中,c(NH4+)___c(HCO3-)(填“>”、“<”或“=”);反应NH4++HCO3-+H2O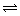 NH3·H2O+H2CO3的平衡常数K=____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5mol·L-1,H2CO3的电离平衡常数K1=4×10-7mol·L-1,K2=4×10-11mol·L-1)
NH3·H2O+H2CO3的平衡常数K=____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5mol·L-1,H2CO3的电离平衡常数K1=4×10-7mol·L-1,K2=4×10-11mol·L-1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com