
A、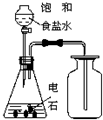 制备并收集乙炔 |
B、 除去乙醇中溶有的少量乙酸 |
C、 制备少量乙酸乙酯 |
D、 石油的分馏 |


科目:高中化学 来源: 题型:
 元素周期表中,金属和非金属分界线附近的元素性质特殊,其单质及化合物应用广泛,成为科学研究的热点.
元素周期表中,金属和非金属分界线附近的元素性质特殊,其单质及化合物应用广泛,成为科学研究的热点.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、锌是负极,氧化银是正极 |
| B、锌发生还原方应,氧化银发生氧化反应 |
| C、溶液中OH-向正极移动,K+、H+向负极移动 |
| D、在电池放电过程中,电解质溶液的酸碱性基本保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| Mg |
| THF |
| BrR2 |
| Li,THF室温 |
| H3O+ |
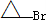 是化合物B的一种同分异构体,用核磁共振氢谱可以证明该化合物中有
是化合物B的一种同分异构体,用核磁共振氢谱可以证明该化合物中有 的有机反应类型
的有机反应类型| NaOH水溶液 |
| △① |
| HBr |
| ② |
| Cu,O2,△ |
| ③ |
| 新制Cu(OH)2 |
| △④ |
| 酸化 |
| ⑤ |
| -HBr |
| ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铊比铝的金属性更强 |
| B、铊能与盐酸反应放出氢气 |
| C、铊在化合物中可以是+3价 |
| D、氢氧化铊一定具有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu与Cu2O的物质的量之比为2:1 |
| B、硝酸的物质的量浓度为2 mol/L |
| C、Cu、Cu2O与硝酸反应后剩余HNO3的物质的量为0.5mol |
| D、产生的NO在标准状况下的体积为2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅材料广泛用于光纤通讯 |
| B、工艺师利用盐酸刻蚀石英制作艺术品 |
| C、粗硅制备单晶硅不涉及氧化还原反应 |
| D、水晶项链和餐桌上的瓷盘都是硅酸盐制品 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com