
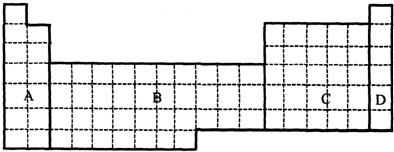
分析 (1)副族和第ⅤⅢ族元素均为金属元素;
(2)短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子数的2倍,则X为C元素;Y元素单质为双原子分子,其氢化物水溶液呈碱性,氢化物为氨气,则Y为N元素;1mol单质Z跟盐酸完全反应,能置换出22.4L的H2(标准状况),n(H2)=$\frac{22.4L}{22.4L/mol}$=1mol,由电子守恒可知Z元素的最外层电子数为$\frac{1mol×2×(1-0)}{1mol}$=2,则Z为Mg元素;W元素原子核外M层电子数目比K层多1个,即最外层(M层)电子数为3,即W为Al,以此来解答.
解答 解:(1)(a)A中含H及碱金属、碱土金属,H为非金属元素,故不选;
(b)B含副族和第ⅤⅢ族元素,均为金属元素,故选;
(c)C中为ⅢA~ⅤⅡA族元素,含多种非金属元素,如N、O、F、As等,故不选;
(d)D为零族元素,均为非金属元素,故不选;
故答案为:(b);
(2)短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子数的2倍,则X为C元素;Y元素单质为双原子分子,其氢化物水溶液呈碱性,氢化物为氨气,则Y为N元素;1mol单质Z跟盐酸完全反应,能置换出22.4L的H2(标准状况),n(H2)=$\frac{22.4L}{22.4L/mol}$=1mol,由电子守恒可知Z元素的最外层电子数为$\frac{1mol×2×(1-0)}{1mol}$=2,则Z为Mg元素;W元素原子核外M层电子数目比K层多1个,即最外层(M层)电子数为3,即W为Al,
①X为C,质子数为6,其一种核素的化学符号126C (或136C、或146C均可),故答案为:126C (或136C、或146C均可);
②Y为N,原子结构中有2个电子层、最外层电子数为5,在周期表中的位置为第2周期第VA族,故答案为:第2周期第VA族;
③金属性Mg>Al,可利用金属失去电子的难易程度、与酸反应的剧烈程度、最高价氧化物对应水化物的碱性等比较金属性,则
(a)比较两种元素单质的熔点,与金属性无关,故不选;
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应,Mg反应速率快,Mg的金属性强,故选;
(c)比较这两种元素的最高价氧化物对应水化物的碱性,氢氧化镁的碱性强、则Mg的金属性强,故选;
(d)比较这两种元素的气态氢化物的稳定性,可比较非金属的非金属性,不能比较金属的性质,故不选;
故答案为:Mg;(b)、(c).
点评 本题考查位置、结构、性质的关系及应用,为高频考点,涉及元素的位置、元素周期表与元素周期律的关系等,题目难度不大,注意(2)中元素的推断及金属性比较方法的应用.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:选择题

| A. | 电极a是负极 | |
| B. | 电极b上的电极反应为O2+2H2O+4e-=4OH- | |
| C. | 外电路中电子由电极b流向电极a | |
| D. | 氢氧燃料电池的优点是高效、对环境友好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高正化合价依次增大 | |
| C. | Li、Na、K的电子层数依次增多 | |
| D. | N、O、F得电子能力依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X>Z>Y>W | B. | Z>W>X>Y | C. | Z>Y>X>W | D. | Z>X>Y>W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吃馒头时越嚼越感觉甜是因为淀粉发生了水解反应 | |
| B. | 变质的油脂有难闻的哈喇味是因为油脂发生了加成反应 | |
| C. | 人体中没有水解纤维素的酶,所以纤维素在人体中没有任何作用 | |
| D. | 牛奶中含有丰富的蛋白质,所以羊毛衫上沾有奶渍时可以用加酶洗衣粉洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,44.8L苯中分子数为2NA | |
| B. | 1mol水中含氢离子数为NA | |
| C. | 5.6g铁与足量稀硫酸完全反应失去电子数为0.3NA | |
| D. | 16gCH4与18gNH4+ 所含电子数均为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | W | ||
| X | Z | Q |
| A. | X的氧化物是红宝石、蓝宝石的主要成分 | |
| B. | Q的最高价氧化物的水化物的浓溶液中只存在一种分子 | |
| C. | W的氧化物有多种,其中只有+2价的氧化物有毒,对人体有危害 | |
| D. | Z的单质可由Z的氧化物与Y的单质反应制得,说明单质Y还原性强于单质Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com