
在11g由D和18O组成的水中,含中子数为(NA表示阿伏加德罗常数)( )
|
| A. | NA | B. | 2NA | C. | 6NA | D. | 10NA |
科目:高中化学 来源: 题型:
下列有关高分子材料的表述不正确的是( )
|
| A. | 合成高分子材料都很难降解 |
|
| B. | 塑料、合成纤维、黏合剂、涂料等都是合成高分子材料 |
|
| C. | 棉花、羊毛、天然橡胶等属于天然高分子材料 |
|
| D. | 线型和体型高分子材料在溶解性、热塑性和热固性等方面有较大的区别 |
查看答案和解析>>
科目:高中化学 来源: 题型:
为提纯下列物质(括号内为杂质)选用的试剂和分离方法都正确的是
|
| 物质 | 试剂 | 分离方法 |
| ① | 硝酸钾(氯化钠) | 蒸馏水 | 结晶 |
| ② | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
| ③ | 乙醇(水) | 金属钠 | 蒸馏 |
| ④ | NaCl溶液(Na2S) | AgCl | 过滤 |
A.①③ B.①④ C.② D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组利用下图所示实验装置,使氢气平缓地通过装有金属钙的硬质玻璃管制取氢化钙,并分析产品的成分及纯度。

(1)试管A的作用有 ; 。
(2)请将下列制备氢化钙的操作步骤补充完整:
①打开活塞K通入H2;
② ;
③点燃酒精灯,进行反应;
④反应结束后, ;
⑤拆除装置,取出产物。
(3)经分析,产品中只含钙、氢两种元素。取少量产品,小心加入水中,观察到有气泡冒出,滴入一滴酚酞试液,溶液变红。反应的化学方程式可能有CaH2+2H2O=Ca(OH)2+2H2↑、
。
(4)取2.30 g产品溶于蒸馏水,配成500 mL溶液;取25.00 mL该溶液于锥形瓶中,滴入2滴酚酞试液,用0.2500 mol/L 盐酸滴定;三次平行实验,平均消耗盐酸22.00 mL。
①配制溶液所用的玻璃仪器有烧杯、玻璃棒、量筒、 、 ;
②判断滴定终点的方法是 ;
③产品中两种成分物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素在周围表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
|
| A. | 同一元素不可能既表现金属性,又表现非金属性 |
|
| B. | 第三周期元素的最高正化合价等于它所处的主族序数 |
|
| C. | 短周期元素形成离子后,最外层都达到8电子稳定结构 |
|
| D. | 同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
SO2的催化氧化反应(2SO2+O2⇌2SO3)是一个放热的反应.如果反应在密闭容器中进行,下列有关说法中正确的是( )
|
| A. | 因为反应放热,所以升高温度会使反应速率减慢 |
|
| B. | 通过调控反应条件,SO2可以100%地转化为SO3 |
|
| C. | 当SO2与SO3的浓度相等时,反应达到平衡 |
|
| D. | 使用催化剂的目的是加快反应速率,提高生产效率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D四种短周期主族元素,其原子序数依次增大.A、B可形成A2B和A2B2两种共价化合物,B、C同主族且可形成CB2和CB3两种化合物.完成下列问题.
(1)C的名称为
(2)写出表示非金属性C<D的化学方程式(任一个): .
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期.该元素可与D形成ED2和ED3两种化合物.将E的单质浸入ED3溶液中,溶液由黄色逐渐变为浅绿色,该反应的离子方程式为 .
(4)请依据(3)中的反应,设计一个原电池.要求:画出实验装置图,注明电解质溶液名称、正负极及正负极材料,并标出电子移动方向,写出负极反应式.负极反应式: .

查看答案和解析>>
科目:高中化学 来源: 题型:
右图是一种稀硫对Fe-Gr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是
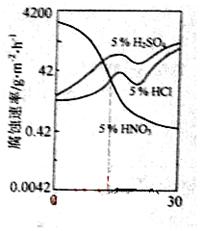 A.稀硫酸对Fe-Cr合金的腐蚀性比稀硫酸和稀盐酸的弱
A.稀硫酸对Fe-Cr合金的腐蚀性比稀硫酸和稀盐酸的弱
B.稀硝酸和铁反应的化学方程式是:Fe+6HNO3(稀)—Fe(NO3)3+3NO2↑+3H2O
C.Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr合金的腐蚀性最强
D.随着Cr含量增加,稀硫酸对Fe-Cr合金的腐蚀性减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com