
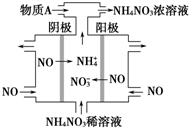
 2015年3月,全国“两会”代表委员就我国“雾霾”治理积极建言献策.科学家研究表明氮氧化物与悬浮在大气中的盐粒子相互作用时能产生“二次雾霾”,涉及的反应有:
2015年3月,全国“两会”代表委员就我国“雾霾”治理积极建言献策.科学家研究表明氮氧化物与悬浮在大气中的盐粒子相互作用时能产生“二次雾霾”,涉及的反应有:分析 (1)依据化学平衡常数概念,结合反应化学方程式书写平衡常数,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
(2)反应达到正逆反应速率相同,各组分含量保持不变,以及选项的分析判断,原则为变量不变证明反应达到平衡状态;
(3)①依据平衡三段式列式计算,依据反应速率概念计算V=$\frac{△c}{△t}$、转化率概念的计算,转化率=$\frac{消耗量}{起始量}$×100%;
②反应(Ⅱ)在恒压条件下进行,随反应进行,气体体积减小,为保持恒压所以容器体积减小,压强比恒容容器大,平衡正向进行,平衡时NO的转化率α2 增大;平衡常数随温度变化,不随浓度、压强变化,平衡常数随温度变化;
(4)工业上电解NO制备 NH4NO3,由装置图可知阳极发生氧化反应,NO被氧化生成NO3-,阴极发生还原反应,NO被还原生成NH4+,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,结合电极方程式解答该题;
(5)根据物质的物质的量与热量成正比计算费用焓变,结合热化学方程式的书写方法标注物质聚集状态和对应反应的焓变书写.
解答 解:(1)2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g),固体不写入平衡常数表达式,反应的平衡常数K1=$\frac{c(ClNO)}{{c}^{2}(N{O}_{2})}$;
故答案为:$\frac{c(ClNO)}{{c}^{2}(N{O}_{2})}$;
(2)恒温恒容条件下,反应(Ⅱ)2NO(g)+Cl2(g)?2ClNO(g)是气体体积减小的反应;
a.反应前后气体物质的量减小,体系压强保持不变,说明反应达到平衡状态,故a正确;
b.平衡状态氯气是黄绿色气体,混合气体颜色保持不变说明反应达到平衡状态,故b正确;
c.NO和ClNO的物质的量相等是反应的定量关系,在反应过程中和平衡状态下和起始量有关,不能说明反应达到平衡状态,故c错误;
d.每消耗0.1mol NO的同时消耗0.05mol Cl2,只能说明反应正向进行,不能说明正逆反应速率相同,故d错误;
故答案为:ab;
(3)①在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(Ⅱ)达到平衡,测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,物质的量为7.5×10-3mol•L-1•min-1×10min×2L=0.15mol,
2NO(g)+Cl2(g)?2ClNO(g),
起始量(mol) 0.2 0.1 0
变化量(mol) 0.15 0.075 0.15
平衡量(mol) 0.05 0.025 0.15
则平衡后n(Cl2)=0.025mol,
NO的转化率α1=$\frac{0.15mol}{0.2mol}$×100%=75%;
故答案为:75%;
②其他条件保持不变,反应(Ⅱ)在恒压条件下进行,随反应进行,气体体积减小,为保持恒压所以容器体积减小,压强比恒容容器大,平衡正向进行,平衡时NO的转化率α2 增大;平衡常数随温度变化,不随浓度、压强变化;
故答案为:>; 不变;
(4)电解NO制备NH4NO3,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3,
故答案为:NO+5e-+6H+═NH4++H2O; NH3;
(5)6.0g即0.1mol液态偏二甲肼与足量的液态四氧化二化氮完全反应生成N2(g)、CO2(g)、H2O(g)、放出225.0kJ的热量,所以1mol液态偏二甲肼与足量的液态四氧化二化氮完全反应生成N2(g)、CO2(g)、H2O(g)、放出2250kJ的热量,则热化学方程式为:C2H8N2+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g)△H=-2250kJ/mol;
故答案为:C2H8N2(l)+4NO2(l)═3N2(g)+2CO2(g)+4H2O(g)△H=-2250.0kJ/mol.
点评 本题考查了化学平衡常数、化学平衡标志的分析应用,化学平衡转化率计算,影响化学平衡因素分析,原电池原理应用,热化学方程式书写方法,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 空气质量与我们的健康息息相关,目我国通过检测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2、和CO是其中3项中的污染物.
空气质量与我们的健康息息相关,目我国通过检测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2、和CO是其中3项中的污染物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应达到平衡后,其他的条件不变的情况下,升高温度,压强一定增大 | |
| B. | 在上述平衡体系中再加入1molA和0.5molB,平衡正向移动,A的转化率增大 | |
| C. | 该反应的热化学方程式2A(g)+B(g)?C(g)+3D(l)+4E(g)△H=-QkJ/mol | |
| D. | 该反应在任何温度下都可自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
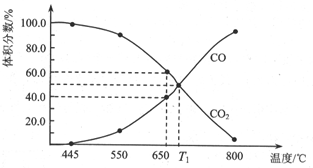 一定量的CO2与足量的C在恒容密闭容器中发生反应:C(s)+CO2(g)?2CO(g)△H.
一定量的CO2与足量的C在恒容密闭容器中发生反应:C(s)+CO2(g)?2CO(g)△H.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
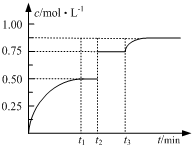 一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器,发生反应:
一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器,发生反应:| A. | 若t1=2,则反应在0~2 min内的平均速率为v(A)=0.50 mol•(L•min)-1 | |
| B. | 若t3时刻升高了温度,则该反应的△H>0 | |
| C. | 若t1时刻后向体系中加入A、B、C各1 mol,则υ(正)>υ(逆) | |
| D. | 温度不变,若起始向容器中加入1 mol A、1 mol B、2 mol D,则达平衡时A的转化率小于50% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇和CO2可直接合成DMC:2CH3OH(g)+CO2 (g)?CH3OCOOCH3 (g)+H2O(g),但甲醇转化率通常不会超过1%,制约该反应走向工业化生产.
甲醇和CO2可直接合成DMC:2CH3OH(g)+CO2 (g)?CH3OCOOCH3 (g)+H2O(g),但甲醇转化率通常不会超过1%,制约该反应走向工业化生产.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何温度下反应均难以自发进行 | B. | 任何温度下反应均可以自发进行 | ||
| C. | 仅常温下反应可以自发进行 | D. | 仅高温下反应可以自发进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com