
【题目】常温下,分别将四块形状相同、质量为7g的铁块同时投入下列四种溶液中。铁块最快溶解完的是( )
A.250.0mL2mol·L-1HClB.150.0mL2mol·L-1H2SO4
C.40.0mL5mol·L-1HClD.20.0mL18.4mol·L-1H2SO4
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:![]() ,若维持温度和压强不变,当达到平衡时,容器的体积为VL,其中C的体积分数为
,若维持温度和压强不变,当达到平衡时,容器的体积为VL,其中C的体积分数为![]() ,下列推断中正确的是
,下列推断中正确的是![]()
①原混和气体的体积为![]()
②反应前气体A有![]()
③反应平衡时气体B消耗掉![]()
④平衡时B的体积分数为![]()
A.①③B.①④C.②③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 100g46%甲酸(HCOOH)水溶液所含的氧原子数为5NA
B. 标准状况下,18g冰水中共价键的数目为NA
C. 56g铁与71gCl2充分反应,转移电子数目为3NA
D. 7.8gNa2O2与足量的水(H218O)反应生成的氧气所含的中子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中常以草酸钠![]() 为标准液,通过氧化还原滴定来测定高锰酸钾溶液的浓度,其反应的化学方程式为:
为标准液,通过氧化还原滴定来测定高锰酸钾溶液的浓度,其反应的化学方程式为:![]() 下列有关草酸钠滴定高锰酸钾实验的叙述,正确的是( )
下列有关草酸钠滴定高锰酸钾实验的叙述,正确的是( )
A.滴定过程中,高锰酸钾被氧化,草酸钠被还原
B.用碱式滴定管量取高锰酸钾溶液
C.该反应中,消耗的草酸钠与高锰酸钾的物质的量之比为5:2
D.为便于滴定终点的判断,滴定时必须往体系中加入指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的混合气体在密闭容器中发生如下反应:xA(g)+yB(s)![]() zC(g)。达到平衡后测得A气体的浓度为0.5mol·L-1。当恒温下将密闭容器的容积扩大到原来的二倍,再达平衡后,测得A的浓度为0.2mol·L-1。下列叙述不正确的是( )
zC(g)。达到平衡后测得A气体的浓度为0.5mol·L-1。当恒温下将密闭容器的容积扩大到原来的二倍,再达平衡后,测得A的浓度为0.2mol·L-1。下列叙述不正确的是( )
A.平衡向正反应方向移动B.z<x+y
C.C的体积分数增大D.A的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
B | 浓氨水 | 碱石灰 | AgNO3溶液 | AgOH具有两性 | |
C | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 | |
D | 稀盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
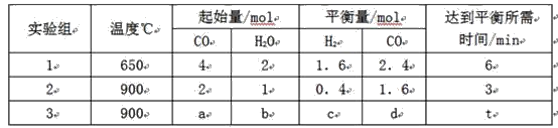
①实验2条件下平衡常数K=______________。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值_______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时v正_________v逆(填“<”,“>”,“=”)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________
(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1H2C2O4溶液中滴加10mL 0.01mol·L-1NaOH溶液时,比较溶液中各种离子浓度的大小关系_____________;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为_______________mol/L。
(5)以二甲醚(CH3OCH3)、空气、H2SO4为原料,铂为电极可构成燃料电池,其工作原理与甲烷燃料电池的原理相似。请写出该电池负极上的电极反应式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.5mol/L的盐酸与50mL0.55moL/L 的 NaOH 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。
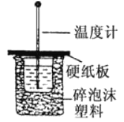
回答问题:
(1)从实验装置上看,图中尚缺少一种玻璃仪器,这种玻璃仪器的名称是_____;能否改用铁丝________ (填“能、否”),原因是____;
(2)烧杯间填满碎泡沫塑料的作用是_____;实验时氢氧化钠溶液的浓度要用 0.55 mol/L 的原因是:_____________。
(3)实验中改用 60mL0.50moL/L 盐酸跟 50mL0.55moL/L 的 NaOH 溶液进行反应,与上述实验相比,所放出的热量____ (填“偏大”“相等”或“偏小”),所求中和热_______(填“相等”或“不相等”)。
(4) 若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同, 而终止温度与起始温度差分别为①3.1℃②3.2℃ ③2.7℃,则最终代入计算式的温差均值为______ ℃ (保留 2 位小数)
(5)近似地认为 0.55mol/L NaOH 溶液和 0.5mol/L 盐酸密度都是1 g/cm3,中和后生成溶液的比热容 c=4.18 J/(g·℃), 则中和热ΔH=_____kJ/moL (取小数点后一位)
(6)上述实验数值结果与 57.3 kJ/mol 相比偏小,产生偏差的原因可能是(填字母)___________
a.实验装置保温、隔热效果差
b.配制 0.55 mol/L NaOH 溶液定容时俯视刻度线读数
c.分多次把 NaOH 溶液倒入盛有盐酸的小烧杯中
d.用温度计测定 NaOH 溶液起始温度后直接测定盐酸溶液的温度
e.用量筒量取盐酸溶液的体积时仰视读数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com