
| T/K | T1 | 573 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |

| ||
| 物 质 | 燃烧热(kJ?mol-1) |
| H2(g) | △H1 |
| CO(g) | △H2 |
| CH4(g) | △H3 |
| ||
| 一定条件 |
| △c |
| △t |
| 0.1mol/L |
| 4min |
| 1 |
| 2 |
| 1 |
| 2 |
 ;
;| 1 |
| 2 |
| 1 |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、为了增加食物的营养成分,可以大量使用食品添加剂 |
| B、高纯硅及其氧化物在太阳能电池及信息高速传输中有重要应用 |
| C、石英只能用于生产光导纤维 |
| D、从海水中提取物质都必须通过化学反应才能实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)在95℃时,纯水的pH
(1)在95℃时,纯水的pH查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
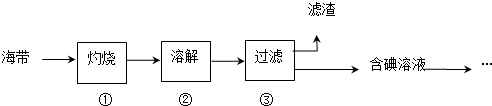
| 实验步骤 | 预期现象与结论 |
| 步骤1:取食盐样品约2g置于表面皿中,滴入3滴淀粉溶液 | 若显蓝色,则假设1成立.若不显蓝色,则进行步骤2 |
| 步骤2: | |
| 步骤3: | |
| … |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 8.3 | 9.6 |
| 沉淀完成 | 3.7 | 9.6 | 9.8 | 11.1 |

查看答案和解析>>
科目:高中化学 来源: 题型:
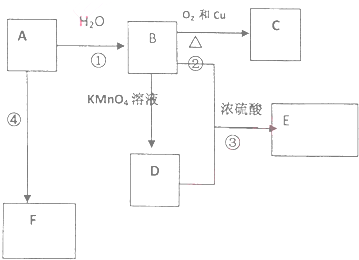
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
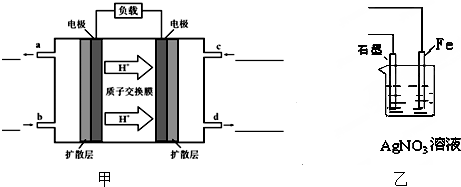
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com