
已知2Zn(s)+O2(g)= 2ZnO(s);ΔH=-700 kJ/mol,则1 g Zn在氧气中燃烧放出的热量约为( )
A.5.4 kJ B.350 kJ C.3.5 kJ D.8.5 kJ
科目:高中化学 来源: 题型:
硫代硫酸钠( Na2S2O3)可用做分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3 +CO2制得。实验室模拟该工业过程的装置如图所示。
回答下列问题:
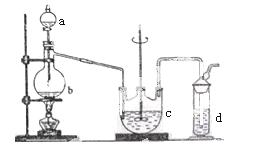
(1)b中反应的离子方程式为__________________,c中试剂为_______________ ______。
______。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是____________________。
(3)d中的试剂为____________。
(4)实验中要控制SO2生成速率,可以采取的措施有______________________(写出两条)。
(5)为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA代表阿伏加德罗常数的值,下列说法中正确的是
A.1L 1mol·L-1的CH3COOH溶液中含有NA个氢离子
B.含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol·L-1
C.0.1mol金属钠在过量氧气中充分燃烧,生成的化合物中离子总数为0.15NA
D.在VLCO和NO的混合气体中含有的氧原子个数为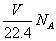
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的值。下列叙述正确的是
A.常温常压下,46g NO2与N2O4的混合气体中含有的分子总数为NA
B.0.1mol乙烯和乙醇的混合物完全燃烧所消耗O2的分子数为0.3NA
C.25。C时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1 NA
D.一定量的钠与8g氧气作用,若两者均无剩余,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E的+1价阳离子的核外有3层电子且各层均处于全满状态。
(1)E元素基态原子的核外电子排布式为__________________________ ______________________________________________。
(2)B、C、D三种元素的第一电离能由小到大的顺序为________(填元素符号),其原因是__________________________________________ ______________________________。
(3)B2A4是石油炼制的重要产物之一 。B2A4分子中B原子轨道的杂化类型为________;1 mol B2A2分子中含________mol σ键。
(4)已知D、E能形成晶胞结构如图所示的两种化合物,则化学式:甲为____________________,乙为______________________;高温时,甲易转化为乙的原因为______________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中错误的是( )
A. 盐类都能水解
B. 配制FeCl3溶液,为了抑制水解,常加入盐酸
C. 盐类的水解反应,通常是吸热反应
D. 盐类水解是指组成盐的离子跟水电离出来的H+或OH—生成弱电解质的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
一定质量的无水乙醇完全燃烧时放出的热量为Q,它所生成的CO2用过量的饱和石灰水完全吸收可得100gCaCO3沉淀,则完全燃烧1mol无水乙醇时放出的热量是( )
A.0.5Q B. Q C. 2Q D.5Q
查看答案和解析>>
科目:高中化学 来源: 题型:
将等物质的量的A和B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g),经5 分
钟后,测得 D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,C的平均反应速率是0.1 mol·L-1·min-1。A在5
D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,C的平均反应速率是0.1 mol·L-1·min-1。A在5
min末的浓度是________,B的平均反应速率是________,D的平均反应速率是________,x的值是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用固体NaOH配制250 mL 0.5 mol·L-1NaOH溶液;
(1)在下列仪器中:①托盘天平(带砝码);②量筒;③烧杯;④玻璃棒;⑤漏斗;⑥500 mL容量瓶;⑦药匙;⑧250 mL容量瓶;⑨胶头滴管;⑩坩埚。
A.配制过程中必须用到的仪器有:___________________________(填写代号)。
B.容量瓶使用前应__________,中学化学实验常用仪器中使用前和容量瓶使用有相同操作的不同类玻璃仪器还有:________、________;
(2)下列操作使所配制的NaOH溶液浓度偏高的有:________(填写代号)。
①称取固体NaOH时未用小烧杯
②没有用水冲洗烧杯2~3次
③定容时,俯视液面使之与刻度相切
④溶液配好摇匀后,发现液面低于刻度线,又加水至液面与刻度相切
⑤将未冷却的溶液注入容量瓶后,马上定容
⑥样品中混有Na2O杂质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com