
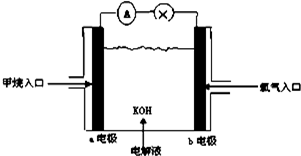
分析 该燃料电池中,电解质溶液呈碱性,所以负极上燃料失电子发生氧化反应,所以a电极反应式为CH4-8e-+10OH-═CO32-+7H2O,b电极为正极,电极反应式为O2+4e-+2H2O═4OH-,在得失电子相等的条件下,正负极电极反应式相加即得电池反应式,结合甲烷和电子之间的关系式计算.
解答 解:(1)甲烷燃料电池的能量转化主要形式是化学能转变为电能,故答案为:化学能转变为电能;
(2)燃料电池中,电解质溶液呈碱性,所以通燃料的a为负极,燃料失电子发生氧化反应,所以a电极反应式为CH4-8e-+10OH-═CO32-+7H2O,Pt(b)电极为正极,发生还原反应,电极方程式为O2+4e-+2H2O═4OH-,
故答案为:负;CH4-8e-+10OH-═CO32-+7H2O;还原;O2+4e-+2H2O═4OH-;
(3)正负极电极反应式相加即得电池反应式为CH4+2OH-+2O2═CO32-+3H2O,故答案为:CH4+2OH-+2O2═CO32-+3H2O;
(4)设甲烷的物质的量为x,
CH4-8e-+2H2O═CO2+8H+
1mol 8mol
x 4mol
1:8mol=x:4mol
x=0.5mol,
故答案为:0.5.
点评 本题考查原电池原理,侧重考查电极反应式书写,结合电解质溶液书写电极反应式,注意:碱性条件下不能生成氢离子,题目难度中等.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应A(g)?2B(g)△H,若正反应的活化能为Ea kJ/mol,逆反应的活化能为Eb kJ/mol,则△H=-( Ea-Eb)kJ/mol | |
| B. | 常温下,pH相同的NaOH溶液和Ba(OH)2溶液中,水的电离程度相同 | |
| C. | 某温度氯化钠在水中的溶解度是20 g,该温度饱和氯化钠溶液的质量分数为20% | |
| D. | 将浓度为0.1 mol/L HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,$\frac{c({F}^{-})}{c({H}^{+})}$始终保持增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H10的属于烷烃的同分异构体有3种 | |
| B. | 分子组成是C5H10属于烯烃的同分异构体有6种 | |
| C. | 分子组成是C4H8O属于醛类的同分异构体有3种 | |
| D. | 结构为 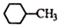 的物质的一溴代物有5种 的物质的一溴代物有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C和D能形成D2C2的离子化合物 | |
| B. | 由A、D原子构成的分子的结构是正四面体 | |
| C. | E和C只能形成E2C 一种化合物 | |
| D. | 由A、B、C、D四种元素形成的化合物可以是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若1mol A2和1 mol B2的总能量之和大于生成的1 mol AB的总能量,则反应放热 | |
| B. | 若1mol A2和1 mol B2的总能量之和小于生成的2 mol AB的总能量,则反应放热 | |
| C. | 若该反应为放热反应,则Q1+Q2<2Q3 | |
| D. | 若该反应为吸热反应,则Q1+Q2<Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com