
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
下列说法正确的是
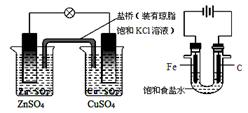
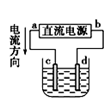
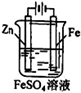
① ② ③ ④
A.图①铜锌原电池工作时,盐桥中的K+移向ZnSO4溶液
B.图②装置反应一段时间,将湿润的KI淀粉试纸靠近碳电极管口,试纸变蓝
C.用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
D.用装置④可进行铁片镀锌
查看答案和解析>>
科目:高中化学 来源: 题型:
⑴已知4NH3(g)+5O2(g)=4NO(g) +6H2O(l),△H=x kJ/mol。蒸发1mol 液态水需要吸收的能量为44kJ,其它相关数据如下表:
| NH3(g) | O2(g) | NO(g) | H2O(g) | |
| 1mol分子断裂化学键时需要吸收的能量/kJ | a | b | z | d |
则表中z(用x、a、b、d表示)的大小为______________________________________________
⑵已知a g 乙烯气体充分燃烧时生成1molCO2和液态水,放出b k J的热量,则乙烯燃烧热的热化学方程式为________________________________________________。
⑶利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可以制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 。
⑷肼(N2H4)—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。该电池放电时,负极的电极反应式是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A~M为中学化学的常见物质,它们之间的转化关系如图所示,部分生成物和反应条件省略。已知C、D是由元素X、Y、Z中的两种组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子 最外层电子数之和为10。D为无色气体且不能燃烧,G为黄绿色单质气体,J、M为金属,
最外层电子数之和为10。D为无色气体且不能燃烧,G为黄绿色单质气体,J、M为金属, I有漂白作用,反应①常用于制作印刷电路板。请回答
I有漂白作用,反应①常用于制作印刷电路板。请回答 下列问题:
下列问题:
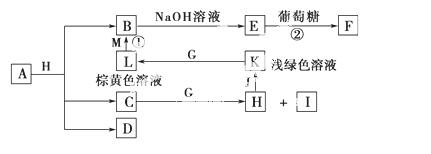
(1)写出A的化学式:____________。
(2)比较Y与Z的原子半径大小:_______ _>________(填元素符号)。
_>________(填元素符号)。
(3)检验L溶液中金属阳离子的方法是_ ___________________________
___________________________
____________________________________________。
(4)已知F溶于稀硝酸,溶液变成蓝色,放出无色气体。请写出该反应的化学方程式:_________________________________________________________
_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
以下除去杂质所选择的试剂和关键操作都正确的是( )
A. 硝基苯中含有少量的硫酸和硝酸:加入水;洗涤,过滤
B. 溴苯中含有少量溴:加入苯;萃取、分液
C. 乙酸乙酯中含有少量乙酸:加入酒精和浓硫酸;加热反应除去
D. 酒精中含有少量水:加入生石灰;蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
现有三组混合液:①菜子油和醋酸钠溶液 ②苯甲酸和乙酸 ③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe2++H2O2+2H+=2Fe3++2H2O,2Fe3++H2O2=2Fe2++O2↑+H+,下列说法正确的是( )
A.H2O2的氧化氢比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中, Fe2+和Fe3+的总量保持不变
D.H2O2生产过程要严格避免混入Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
C1SO3H称为氯磺酸,是一种强酸。对于反应:
ClSO3H+HCOOH=CO+HCl+H2SO4有如下判断,其中较合理的是 ( )
A.此反应属于氧化还原反应 B.此反应不属于氧化还原反应
C.反应后溶液的pH值变小 D.反应后溶液的pH值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
其某化学兴趣小组在实验失室制取漂白粉,并探究氯气与石灰乳反应的条件和产物。已知:①二氧化锰与浓盐酸反应可制备氯气:MnO2 +4HCl(浓)=MnCl2+Cl2↑+H2O
②氯气和碱反应为放热反应。温度较高时,氯气和碱还能发生如下反应: 6Cl2+6Ca(OH)2 5CaCl2+Ca(ClO3)2+6H2O
5CaCl2+Ca(ClO3)2+6H2O
该兴趣小组设计了下列实验装置,进行实验。
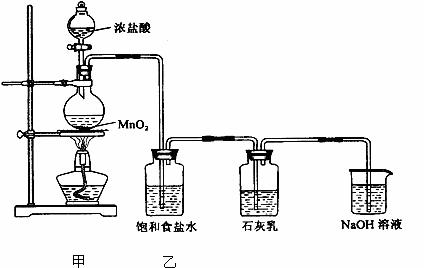
请回答下列问题:
(1)①甲装置用于制备氯气,乙装置的作用是___________ 。
 ②该兴趣小组用8.7g MnO2与足量的浓盐酸充分反应,可以收集到氯气(标准状况) ,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2______________g。
②该兴趣小组用8.7g MnO2与足量的浓盐酸充分反应,可以收集到氯气(标准状况) ,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2______________g。
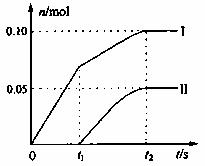
(2)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值。他们讨论后认为,及温度升高导致反应发生变化是可能原因。为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢匀速地通入足量氯气,得出了ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为右图(不考虑氯气和水的反应)。
①图中曲线II表示_____________离子的物质的量随反应时间变化的关系。
②所取石灰乳中含有Ca(OH)2的物质的量为______________mol。
(写出计算过程)
(3)为了提高Ca(ClO)2的产率,可对丙装置作适当改进。请你给出一种改进方法:________ _。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com