
����Ŀ�� H2O2��һ����ɫ�Լ����ڻ�ѧ��ҵ�����������������ᡢ�������Ƶȵ�ԭ�ϣ�ҽҩ��ҵ����ɱ������������.ij��ѧС����̽��˫��ˮ��������������ʵ�飺
(1)�±��Ǹ�С���о�Ӱ���������(H2O2)�ֽ����ʵ�����ʱ�ɼ���һ�����ݣ���![]() ��ȡ
��ȡ![]() �����ʱ��
�����ʱ��![]() ��
��![]()
Ũ�� ʱ�� ��Ӧ���� |
|
|
|
|
������������ | ��������Ӧ | ��������Ӧ | ��������Ӧ | ��������Ӧ |
���������� | 360 | 480 | 540 | 720 |
| 10 | 25 | 60 | 120 |
���о�С������Ʒ���ʱ��������Ũ�ȡ� ______ �� ______ ���ضԹ�������ֽ����ʵ�Ӱ�졣(2)��һ�о�С������ͬŨ��Fe3+�Ĵ��£�̽��H2O2Ũ�ȶ�H2O2�ֽⷴӦ���ʵ�Ӱ�죬��ѡ�Լ�������![]() ��
��![]() ������ˮ����ƿ��˫������ˮ�ۡ����ܡ��������ܡ���Ͳ�����������ˮԡ�ۡ�ע���������ʵ��װ�ã����ͼ1�����ڵ�װ��ʾ��ͼ
������ˮ����ƿ��˫������ˮ�ۡ����ܡ��������ܡ���Ͳ�����������ˮԡ�ۡ�ע���������ʵ��װ�ã����ͼ1�����ڵ�װ��ʾ��ͼ![]() Ҫ������õ�������ֱ�����ַ�Ӧ���ʴ�С_________
Ҫ������õ�������ֱ�����ַ�Ӧ���ʴ�С_________

(3)����H2O2�ֽⷴӦ��![]() Ҳ��һ���Ĵ����á�Ϊ�Ƚ�Fe3+��
Ҳ��һ���Ĵ����á�Ϊ�Ƚ�Fe3+��![]() ��H2O2�ֽ�Ĵ�Ч�����о�С���ͬѧ�������ͼ2��ʾ��ʵ�顣��ش�������⣺
��H2O2�ֽ�Ĵ�Ч�����о�С���ͬѧ�������ͼ2��ʾ��ʵ�顣��ش�������⣺
�ٿ�ͨ���۲� ____________ ���Ƚϵó����ۡ�
����ͬѧ�����![]() ��
��![]() ��Һ��Ϊ
��Һ��Ϊ![]() ��Ϊ�������������� _________ ��
���������������� _________ ��
(4)��֪![]() ��Һ����Ҫ����H2O��Fe3+��Cl-����������ͬѧ���������ֲ��룺
��Һ����Ҫ����H2O��Fe3+��Cl-����������ͬѧ���������ֲ��룺
����1���������ֽ�H2O2����![]() ��Һ�е�Fe3+
��Һ�е�Fe3+
����2���������ֽ�H2O2���� __________________
��ɱ�����֤���룺
�����Լ� | ���������� | ���� |
_________ | __________ | Cl-��H2O2�ֽ������� |
���𰸡��¶� ���� 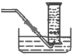 ��Ӧ�������ݿ��� ���������Ӳ�ͬ��ʵ��ĸ��� Cl- ˫��ˮ������ ��ʢ��H2O2��Һ���Թ��м���������HCl��Ȼ��Ѵ����ǵ�ľ�������Թ��У�ľ������ȼ
��Ӧ�������ݿ��� ���������Ӳ�ͬ��ʵ��ĸ��� Cl- ˫��ˮ������ ��ʢ��H2O2��Һ���Թ��м���������HCl��Ȼ��Ѵ����ǵ�ľ�������Թ��У�ľ������ȼ
��������
(1)���������ڳ����º��ѷֽ�õ���������ֽ��ٶ���Ũ�ȡ��¶ȡ����������ص�Ӱ�����ʵ�鷽����֤��ʱ�����Ʊ�����ȷ��ʵ������ȷ�ԣ�
(2)������ˮ�������ռ�һ���������������ʢ��ˮ����Ͳ������ʢˮ��ˮ���У����õ�����ͼ1���ӣ�
(3)�ٸ��ݷ�Ӧ��������Ŀ����������ڸ���FeCl3��![]() �������Ӳ�ͬ��������Ҳ��ͬ�������
�������Ӳ�ͬ��������Ҳ��ͬ�������
(4)����˫��ˮ��Һ����ˮ������ų�ˮ�����������ݲ���1��֪����2Ӧ���������ֽ�H2O2����Cl-��Ϊ��֤����2����ʢ��H2O2��Һ���Թ��м����������������ӵ�������˫��ˮ��Һ�к��е���������������ʵ����֤��
(1)���ݱ��и��������ݣ����������ȵ�����£���ͬŨ�ȵĹ���������Һ����������Ӧ�����������ȵ�����£���ͬŨ�ȵĹ���������Һ���ֽ⣬˵����������ķֽ��������¶��йأ����ǵõ���ͬ�����ʱ�䲻ͬ��Ũ��Խ��Ӧ���ٶ�Խ�죬˵����������ķֽ�������Ũ���йأ��Ƚ�ͬһŨ�ȵĹ���������Һ��30%ʱ�����������ȵ�ʱ����Ҫʱ����360s���д������ȵ������£���Ҫʱ����10s��˵����������ķֽ��������¶ȡ������йأ���˸��о�С������Ʒ���ʱ��������Ũ�ȡ��¶Ⱥʹ������ضԹ�������ֽ����ʵ�Ӱ�죬�ʴ�Ϊ���¶ȡ�������
(2)������ˮ�������ռ�һ�������������������ʢ��ˮ����Ͳ������ʢˮ��ˮ���У����õ�����ͼ1���ӣ�װ��ͼΪ�� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
(3)�����ڹ�������ֽ�������壬���ҷ�Ӧ���ȣ���˿��Ը��ݷ�Ӧ�в������ݵĿ������ж�Fe3+��![]() ��H2O2�ֽ�Ĵ�Ч�����ʴ�Ϊ����Ӧ�������ݿ�����
��H2O2�ֽ�Ĵ�Ч�����ʴ�Ϊ����Ӧ�������ݿ�����
��H2O2�������п�����������������ã���ΪFe2(SO4)3ʹ��������ͬ�������������������Ӳ�ͬ��ʵ��ĸ��ţ���Ϊ�������ʴ�Ϊ�����������Ӳ�ͬ��ʵ��ĸ��ţ�
(4)FeCl3��Һ����Ҫ����H2O��Fe3+��Cl-������������˫��ˮ��Һ����ˮ������ų�ˮ�����������ݲ���1��֪����2Ϊ���������ֽ�H2O2����Cl-��Ϊ��֤����2����ʢ��H2O2��Һ���Թ��м���������HCl��Ȼ��Ѵ����ǵ�ľ�������Թ��У�ľ������ȼ���ó����ۣ�Cl-��H2O2�ֽ������ã��ʴ�Ϊ��Cl-��˫��ˮ�������ʢ��H2O2��Һ���Թ��м���������HCl��Ȼ��Ѵ����ǵ�ľ�������Թ��У�ľ������ȼ��


 ��������ϵ�д�
��������ϵ�д� ����˼ά����ѵ����ʱ��ѧ��ϵ�д�
����˼ά����ѵ����ʱ��ѧ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������л����д����Ӧ�Ľṹ��ʽ��
(1)3-��-2-��ϩ__________________________________________��
(2)��ͪ_____________________________________________________��
(3)��������___________________________________________________��
(4)����_____________________________��
(5)CH2=CH-COOH_________________________
(6)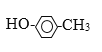 ________________________
________________________
(7)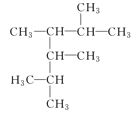 __________
__________
(8)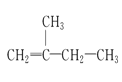 ______________________
______________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��ұ�����ĵ�һ����ӦΪ![]() ��������˵���д�����ǣ� ��
��������˵���д�����ǣ� ��
A.a��ֵΪ2B.��Ӧ��SnO2����ԭ
C.��Ӧ����������������D.1mol SnO2�μӷ�Ӧ����ת��8mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����A�г���1molX��1molY����B�г���2molX��2molY����ʼʱA��B�������ȶ�����aL������ͬ�¶Ⱥʹ������ڵ������£��رջ���K��ʹ�������и��Է����������ȷ�Ӧ��X��g��+Y��g��![]() 2Z��g��+W��g����A���ֺ�ѹ��B���ֺ��ݣ���ƽ��ʱ��A�����Ϊ1.4aL������˵��������� ��
2Z��g��+W��g����A���ֺ�ѹ��B���ֺ��ݣ���ƽ��ʱ��A�����Ϊ1.4aL������˵��������� ��
![]()
A. ��Ӧ���ʣ�v��B����v��A�� B. A������X��ת����Ϊ80%
C. ƽ��ʱ��ѹǿ��PB��2PA D. ƽ��ʱY���������A��B
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��X��Y��Z��W��ԭ������������������ͼ��ʾ������ת����ϵ�У�p��q�� m��n�ֱ���Ԫ��W��X��Y��Z�����嵥�ʣ�p�� s��Ϊ��ɫ���壬v��ˮ��Һ�ʼ��ԡ������£�0.1 mol L ��1t ��Һ�� 0.1 mol L ��1 u ��Һ��pH��Ϊ1������˵������ȷ����
A.Y��W������������Ӧ��ˮ�����Ϊǿ��
B.Z��Y�ļ��⻯����ȶ��Ժͷе�ߵ;�Ϊ��Z��Y
C.s����ˮ�ķ�Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ1:2
D.v�ĵ���ʽ�ɱ�ʾΪ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
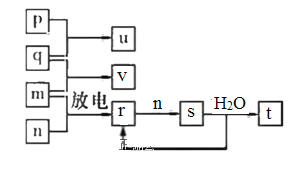
����Ŀ���α������һ������Ѫ�����ŵĽ�Ѫѹҩ�һ�ֺϳ��α�����м���G�IJ����������£�
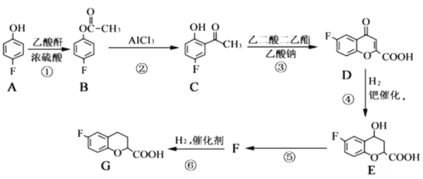
��֪���������Ľṹ��ʽΪ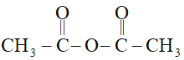
��ش��������⣺
��1��A��������__________��B�����������ŵ�������__________��
��2����Ӧ�ݵĻ�ѧ����ʽΪ__________________���÷�Ӧ�ķ�Ӧ������______________��
��3��G�ķ���ʽΪ________________�������������ԭ�������_________����
��4��д��ͬʱ��������������E��ͬ���칹��Ľṹ��ʽ��________________��
��.������ֻ������ȡ����
��.�˴Ź�������ͼ��ֻ��4�����շ�
��.![]() ������������
������������![]() ��Һ��Ӧ����
��Һ��Ӧ����![]()
��5����������֪ʶ����������Ϣ��д����![]() ��������Ϊԭ���Ʊ�
��������Ϊԭ���Ʊ�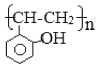 �ĺϳ�·������ͼ�����Լ���ѡ�����ϳ�·������ͼʾ�����£�
�ĺϳ�·������ͼ�����Լ���ѡ�����ϳ�·������ͼʾ�����£�
![]()
__________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ�����ʽṹ�����ʡ����й�֪ʶ���ش��������⣺
��1����ͼ��ʾ��Ԫ�����ڱ��е�һ���ڶ�����10��Ԫ�ص�ijЩ���ʵ�һ������(�������ݵĵ�λ��ͬ)������������������Ԫ���⣬����Ԫ�ض������˸���Ԫ�ص�ȫ���������ݡ�
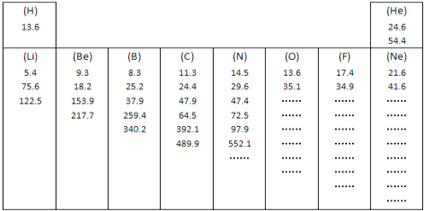
��ЩԪ�ص��������и���ط�����ı������������ر���γ���ͻԾ�����ɴ˿���֤��ԭ�ӽṹ��_______________________�Ľ��ۡ�����������ɣ�����Ϊ��Ԫ��8�������������г�����ͻԾ��������Ӧ���ǵ�________����
��2�������� ��CH3OH ��HCHO ��CS2 ��CCl4�����л��ܼ��У�̼ԭ�Ӳ�ȡsp2�ӻ��ķ�����_____(�����)��������ˮ����_____(�����)�������ǣ�____________��
��3��N��N���ļ���Ϊ946kJ��mol-1��N��N���ļ���Ϊ193kJ��mol-1����һ��������ƽ������Ϊ__________��˵��N2��________�����ȶ�(�����ҡ������С�)��
��4����ʢ������ͭˮ��Һ���Թ�����백ˮ�������γ�����������μӰ�ˮ���������ܽ⣬�õ�����ɫ������Һ��д���йػ�ѧ��Ӧ�����ӷ���ʽ___________��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(ClO2)����ǿ�����ԣ��ڹ�ҵ�ϳ�����ˮ��������Ư����ClO2��һ��������ˮ�Ļ���ɫ���壬�������������10%ʱ������ը��ij�о�С�������������ַ����Ʊ�ClO2���ش��������⣺
��1���Ի�����(FeS2)�������ƺ�������Һ��Ϸ�Ӧ�Ʊ�ClO2���������е���Ԫ�������������±�ClO3-������SO42-��д���Ʊ�ClO2�����ӷ���ʽ__��
��2���ù�����������ԭ��������������л�ԭNaClO3�Ʊ�ClO2�������Ƶõ�ClO2���ڴ�����CN-��ˮ��ʵ����ģ��ù��̵�ʵ��װ��(�г�װ����)��ͼ��ʾ��
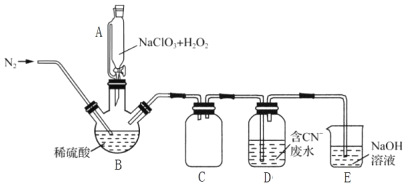
��װ��A��������__��װ��C��������__��
�ڷ�Ӧ����BӦ����30�����ҵ�ˮԡ�У�Ŀ����__��
��ͨ�뵪������Ҫ������3����һ�ǿ����������ã����������ڽ�ClO2�ų�������__��
��ClO2������CN-��ˮ�����ӷ���ʽΪ__��װ��E��������__��
��3���Ȼ��Ƶ�ⷨ��һ�ֿɿ��Ĺ�ҵ����ClO2�ķ�����
�����ڵ���ʳ��ˮ���ȳ�ȥ���е�Ca2+��Mg2+��SO42-�����ʡ�ij�γ��Ӳ���ʱ��������ˮ���ȼ��������__���ѧʽ�������������ٲ������ټ��������Na2CO3��NaOH����ַ�Ӧ����һ����ȥ��
����ʯī���缫����һ�������µ�ⱥ��ʳ��ˮ��ȡClO2������ԭ����ͼ��ʾ��д����������ClO2�ĵ缫��Ӧʽ__��
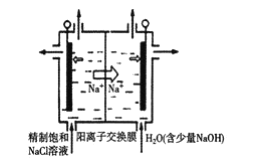
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��֤�����ԣ�Cl2��Fe3+��SO2��ij��ѧ�о���ѧϰС������ͼ��ʾװ�ý���ʵ�飨�г�������A�еļ���װ�����ԣ��������Ѿ�������ϣ���

�������ɼ�K1��K4��ͨ��һ��ʱ��N2���ٽ�T�͵��ܲ���B�У�����ͨ��N2��Ȼ��ر�K1��K3��K4��
��������a���μ�һ������Ũ���ᣬ��A������
������B����Һ���ʱ��ֹͣ���ȣ��н����ɼ�K2��
��������b��ʹԼ2mL����Һ����D�Թ��У��������е���������
�������ɼ�K3������c������70%�����ᣬһ��ʱ���н����ɼ�K3��
���������Թ�D���ظ�������������B��Һ�е�������
��1����������Ŀ����__________________________________________________________��
��2�����н������ҺΪ________________��������_____________________________________________ ��
��3��A�з�����Ӧ�Ļ�ѧ����ʽ________________________________________________��
��4�����²���������Һ��Ƶ����ӷ�Ӧ��________________________________________����________��д�Լ���ѧʽ�������������������____________________________________________ ��
��5����˵��������Fe3+��SO2�����ӷ���ʽ��_______________________________��
��6���ס��ҡ�����λͬѧ�ֱ����������ʵ�飬���ǵļ����һ���ܹ�֤��������:Cl2��Fe3+��SO2����_______��������������������������
��������B��Һ�к��е����� | ��������B��Һ�к��е����� | |
�� | ��Fe3+��Fe2+ | ��SO42�� |
�� | ����Fe3+����Fe2+ | ��SO42�� |
�� | ��Fe3+��Fe2+ | ��Fe2+ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com