
分析 有机物燃烧时,碳元素全部转化为二氧化碳,二氧化碳与足量的氢氧化钙完全反应,生成不溶于水的白色沉淀碳酸钙,利用生成碳酸钙的质量计算燃烧生成二氧化碳的质量;碱石灰既能吸收燃烧生成的水,又能吸收燃烧生成的二氧化碳,因此,增重的质量即燃烧生成二氧化碳和水的质量总和,从而求出水的质量,根据原子守恒确定有机物分子式.
解答 解:(1)设燃烧产物中CO2的质量为x.
CO2+Ca(OH)2=CaCO3↓+H2O
44 100
x 15.0g
所以x=$\frac{15.0g×44}{100}$=6.6g
而碱石灰既能吸收燃烧生成的水,又能吸收燃烧生成的二氧化碳,因此,增重的质量即燃烧生成二氧化碳和水的质量总和:m(CO2)+m(H2O)=9.3g,m(H2O)=9.3g-6.6g=2.7g,
答:燃烧产物中水的质量为2.7g;
(2)n(无色可燃气体)=$\frac{1.68L}{22.4L/mol}$=0.075mol,
n(CO2)=$\frac{6.6g}{44g/mol}$=0.15mol,则n(C)=0.15mol;
n(H2O)=$\frac{2.7g}{18g/mol}$=0.15mol,则n(H)=n(H2O)×2=0.3mol,
即0.075mol气体中含有0.15molC,0.3molH,所以1mol气体中含有2molC,4molH,原气体是一种烃,所以该气体的分子式是C2H4,结构简式为CH2=CH2,
答:该烃的分子式为C2H4,结构简式为CH2=CH2.
点评 本题考查烧法确定有机物分子组成,根据原子守恒法来解答,难度不大.


科目:高中化学 来源: 题型:解答题
 周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,其中F为过渡元素,已知A原子2p轨道有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体熔点在同周期形成的单质中是最高的;F2+核外各电子层电子均已充满.
周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,其中F为过渡元素,已知A原子2p轨道有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体熔点在同周期形成的单质中是最高的;F2+核外各电子层电子均已充满.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有Fe2+ | B. | Na+、Fe3+ | ||
| C. | Na+、Fe3+ 和H+ | D. | H+、Na+、Fe3+ 和Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
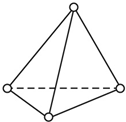 (1)根据要求填空:
(1)根据要求填空: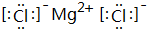
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子.
在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子. ; A2D由液态形成晶体时密度减小(填增大,不变或减小),分析主要原因(用文字叙述)水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小
; A2D由液态形成晶体时密度减小(填增大,不变或减小),分析主要原因(用文字叙述)水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
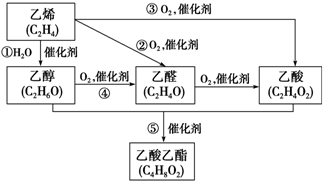 如图是由乙烯合成乙酸乙酯的几种可能的合成路线:
如图是由乙烯合成乙酸乙酯的几种可能的合成路线:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com