
����Ŀ������ˮ�к�����ᵼ�����ж���ˮ�����ܽ������Ҫ��As�����������κ�As��������������ʽ���ڣ�
��1��������Ϊͬһ����Ԫ�أ���ԭ�ӽṹʾ��ͼΪ ��
��2������Ԫ�������ɣ�����˵����ȷ���� ��
a�����ԣ�H2SO4��H3PO4��H3AsO4
b��ԭ�Ӱ뾶��S��P��As
c���ǽ����ԣ�S��P��As
��3�����ڵ���ˮ�������Դ�ж��ּ��裬����һ����Ϊ�Ǹ�����Ļ�����FeS2��������ΪFe��OH��3 �� ͬʱ����SO42�� �� �������������������ˮ��FeS2��O2���������ӷ���ʽΪ ��
��4��ȥ��ˮ���е��飬���Ƚ�As����ת��ΪAs��������ѡ��NaClO��ʵ�ָ�ת�����о�NaClOͶ������As���������ʵ�Ӱ��õ����½����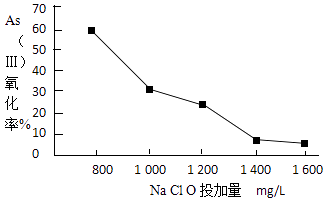
��֪��Ͷ��ǰˮ��pH=5.81��0.1mol/LNaClO��ҺpH=10.5����Һ�����������õ������Ǵ����ᣮ�����˽����ԭ���� ��
��5��ǿ�����ӽ�����������������������̬���ڵ�As�������ﵽȥ��As��Ŀ�ģ�
��֪��һ�������£�As�������Ĵ�����ʽ�����ʾ��
pH | ��2 | 2��7 | 7��11 | 11��14 |
������ʽ | H3AsO4 | H2AsO3�� | HAsO42�� | HAsO42����AsO43�� |
pH=6ʱ��NaClO���������ᣨH3AsO3�������ӷ���ʽ�� ��
���𰸡�
��1��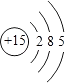
��2��ac
��3��4FeS2+15O2+14H2O=4Fe��OH��3+8SO42��+16H+
��4�����������õ������Ǵ�����,NaClO��ҺΪ����,����������ʱ,��Һ������ǿ,NaClO��ҺŨ������,ˮ��̶Ƚ���,�����������,����As���������ʽ���
��5��HClO+H3AsO3 =H2AsO4��+Cl��+2H+
���������⣺��1����ԭ�Ӻ��������Ϊ15����3�����Ӳ㣬���ﵽ����������Ϊ2��8��5����ԭ�ӽṹʾ��ͼΪ 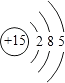 ��
��
�ʴ�Ϊ�� 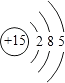 ��
��
��2��a��ͬ����������ҷǽ�������ǿ������������Ӧˮ����������ǿ��ͬ�������϶��·ǽ����Լ���������������Ӧˮ�������Լ��������ԣ�H2SO4��H3PO4��H3AsO4����a��ȷ��
b��ͬ�����������ԭ�Ӱ뾶��С��ͬ�������϶���ԭ�Ӱ뾶��������ԭ�Ӱ뾶��As��P��S����b����
c��ͬ����������ҷǽ�������ǿ��ͬ�������϶��·ǽ����Լ������ǽ����ԣ�S��P��As����c��ȷ��
�ʴ�Ϊ��a c��
��3��FeS2ˮ��Һ�б�O2�����������ᡢ������������Ӧ�Ļ�ѧ����ʽΪ��4FeS2+15O2+14H2O=4Fe��OH��3+8SO42��+16H+��
�ʴ�Ϊ��4FeS2+15O2+14H2O=4Fe��OH��3+8SO42��+16H+��
��4��Ͷ��ǰˮ��pH=5.81��0.1mol/LNaClO��ҺpH=10.5����Һ�����������õ������Ǵ����ᣮ�����˽����ԭ���ǣ����������õ������Ǵ����ᣬNaClO��ҺΪ���ԣ�����������ʱ����Һ������ǿ��NaClO��ҺŨ������ˮ��̶Ƚ��ͣ�����������ɣ�����As���������ʽ��ͣ�
�ʴ�Ϊ�����������õ������Ǵ����ᣬNaClO��ҺΪ���ԣ�����������ʱ����Һ������ǿ��NaClO��ҺŨ������ˮ��̶Ƚ��ͣ�����������ɣ�����As���������ʽ��ͣ�
��5��pH=6ʱ��NaClO��Һ������HClO��pH=6ʱ��NaClO���������ᣨH3AsO3�������ӷ���ʽ�ǣ�HClO+H3AsO3 =H2AsO4��+Cl��+2H+��
�ʴ�Ϊ��HClO+H3AsO3 =H2AsO4��+Cl��+2H+��
��1����Ϊ15��Ԫ�أ���3�����Ӳ㣬���������Ϊ2��8��5��
��2������ͬ����Ԫ�����ʵݱ���ɽ����жϣ�
��3��FeS2ˮ��Һ�б�O2�����������ᡢ����������
��4��ͼ�������߱仯����ҺŨ��Խ����ˮ��̶�ԽС������
��5��pH=6ʱ��NaClO��Һ������HClO��ͼ�з�����֪pH=6ʱAs�������Ĵ�����ʽΪH2AsO4��.


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�ֳ����ķ�ɢϵ���ش��������⣮
������е�����ˮ����μ�����Һ����������� ��
ֹͣ���ȣ����Ƶ�Fe��OH��3���壬��ȡFe��OH��3���廯ѧ��Ӧ����ʽΪ ��
����Fe��OH��3�����м���Na2SO4������Һ���������ӣ������ӷ��ţ������ã�ʹ�����γ��˳�����������̽��� ��
�����ֽ������Һ���õķ������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʵľ����У���ѧ��������ͬ����������Ҳ��ͬ���ǣ� ��
A.CO2��H2O
B.CCl4��KCl
C.NaCl��HCl
D.SO2��SiO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ӧ����㷺�Ľ����������Ȼ���������Լ������ĺ������ξ�Ϊ��Ҫ�����
(1)��д��Fe��ˮ������Ӧ�Ļ�ѧ����ʽ:_____________��
(2)��ʵ�����У�FeCl2�������ۺ�______(������)��Ӧ�Ʊ���
(3)Fe3O4���ö��ַ����Ƶã�������һ�ֵ��ʺ�һ�ֻ�����ͨ�����Ϸ�Ӧ�Ʊ��Ļ�ѧ����ʽΪ______��
(4)��ש������������ս���ɵģ����京��Fe2O3�ʺ�ɫ���غ�ɫ���������������������ϡ������һ����ʵ��֤����ש�к���Fe3+:_________________��
(5)����һ����FeCl2 ��FeCl3�Ļ������Ʒ��ʵ����n(Fe)��n(C1)=1��2.1�������Ʒ��FeCl3�����ʵ�������Ϊ_________��
(6)�������(K2FeO4)��һ��ǿ������������Ϊˮ��������������ز��ϡ�FeCl3��KClO��ǿ���������·�Ӧ����ȡK2FeO4���䷴Ӧ�����ӷ���ʽΪ:____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������ǣ� ��
A.���ά����Ҫ�ɷ��ǹ�����B.�������Ż�ʱ��������ˮ���
C.��������������ɫ�����Ϳ��D.�����¿�����������ʢװŨ�����Ũ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯ���ѽ��еõ���1��3-����ϩ�ɽ������¶ಽ��Ӧ���õ��ȶ������ᡣ
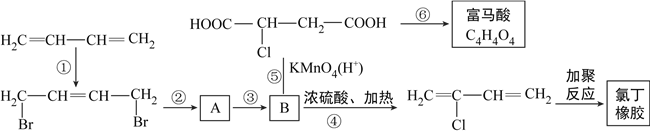
��1��B������Ϊ2-��-1��4-������������д��B�Ľṹ��ʽ____________________��
��2������д���ڢڲ���Ӧ�Ļ�ѧ����ʽ��______________________________��
��3����Ӧ��~���У�������ȥ��Ӧ����______________________________��
��4���л��ϳ��е�·�ߺͲ���ѡ��dz���Ҫ�������ڢڲ��͵ڢ۲���˳���������B�ṹ����____________________��
��5�����û����Ƣۺ͢���������ֱ����KMnO4/H+��������A�����µ������ǣ�______________________________��
��6��ij���л���ķ���ʽΪC5H6O4�����ķ��������������ŵ����ࡢ��Ŀ���븻������ͬ��������˳���칹�������ܵĽṹ��__________�֡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼŨ��������ϡ���ᣬ����˵����ȷ���ǣ� ��

A. ����Ҫ����200mL1.00 mol��L �C1��ϡ���ᣬͨ���������10mL��Ͳ��ȡ9.20mLŨ����
B. Ũ�������������ˮ��Ϻ���ȴ��������Һ��Ũ�ȴ���9.2mol��L �C1
C. ������ʱ��ˮ�����̶��ߺ�Ӧ�ý�ͷ�ι����������Һ��
D. ������ƿת��Һ��ʱ�������ò��������ԽӴ�����ƿ�ڱ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ѧ��ͨ�����Ӽ�����������һ�ܵ�ʵ�飬�����6���dz�������![]() ԭ�ӣ����ţ���ѧ����ʹ�����ƵIJ��������۲����6��ԭ������4��������˥�䣬��һʵ��֤ʵ������Ԥ�Ե�˫����˥�䷽ʽ������һ��ԭ��ͬʱ�ų��������ӵ�˥�䷽ʽ���ش��������⣺
ԭ�ӣ����ţ���ѧ����ʹ�����ƵIJ��������۲����6��ԭ������4��������˥�䣬��һʵ��֤ʵ������Ԥ�Ե�˫����˥�䷽ʽ������һ��ԭ��ͬʱ�ų��������ӵ�˥�䷽ʽ���ش��������⣺
(1) ![]() ԭ�ӵĺ���������Ϊ________����ԭ�ӵĺ��������Ϊ________��
ԭ�ӵĺ���������Ϊ________����ԭ�ӵĺ��������Ϊ________��
(2)���¹���![]() ��������ȷ����________(����ĸ���)��
��������ȷ����________(����ĸ���)��
A�� ![]() ��
��![]() �����ֺ���
�����ֺ���
B����ѧ�һ����һ����Ԫ��
C�� ![]() ��˥�䲻�ǻ�ѧ�仯
��˥�䲻�ǻ�ѧ�仯
D��������ԭ��˥��ų��������Ӻ���![]()
(3)ijͬѧ��Ϊ![]() ��һ��������Ҳ����������Ӧ�������ж�������___________________________��
��һ��������Ҳ����������Ӧ�������ж�������___________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com