
【题目】工业上通常采用N2(g)和H2(g)崔华成NH3(g):N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1
(1)在一定温度下,若将10amolN2和30amolH2放入2L的密闭容器中,充分反应后测得平衡时N2的转化率为60%,则该反应的平衡常数为(用含a的代数式表示).若此时再向该容器中投入10amolN2、20amolH2和20amolNH3 , 判断平衡移动的方向是(填“正向移动”“逆向移动”或“不移动”).
(2)若反应起始时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L.则NH3达到平衡时浓度的范围为;若平衡时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L,则NH3起始时浓度的范围为 .
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 | |
平衡时数据 | 反应能量变化的绝对值(kJ) | Q1 | Q2 | Q3 |
反应物转化率 | a1 | a2 | a3 | |
体系压强(Pa) | p1 | P2 | P3 | |
则Q1+Q2=kJ;a1+a2l(填“<”“>”或“=”下同):2p2p3
(4)如图:A是恒容的密闭容器,B是一个体积可变的充气气囊.保持恒温,关闭K2 , 将1molN2和3molH2通过K3充入B中,将2molN2和6molH2通过K1充入A中;起始时A、B的体积相同均为1L,达到平衡时,V(B)=0.9L;然后打开K2 , 一段时间又达到平衡时,B的体积为L(连通管中气体体积不计). 
【答案】
(1)![]() ;正向移动
;正向移动
(2)0mol/L<c(NH3)<0.3mol/L;0mol/L≤c(NH3)≤0.3mol/L
(3)92.4;=;>
(4)1.7
【解析】解:(1)由10amolH2和30amolN2放入2L的密闭容器中,充分反应后测得N2的转化率为60%,则
N2 + | 3H2 | 2NH3 | |
开始mol/L | 5a | 15a | 0 |
变化mol/L | 5a×60%=3a | 9a | 6a |
平衡mol/L | 2a | 6a | 6a |
平衡常数K= ![]() =
= ![]() =
= ![]() ;
;
若此时再向该容器中投入10amolN2、20amolH2和20amolNH3 , 三者的浓度分别为:7amol/L、16amol/L、16amol/L;则Q= ![]() =
= ![]() =
= ![]() <K,此时平衡正向进行;
<K,此时平衡正向进行;
所以答案是: ![]() ;正向移动;(2)若反应起始时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L,假设反应正向进行,则N2的最大转化浓度为0.1mol/L,则NH3的变化浓度为0.2mol/L,即平衡时NH3的浓度小于0.3mol/L,假设反应逆向进行,则NH3的变化浓度最大为0.1mol/L,即平衡时NH3的最小浓度为大于0mol/L,故NH3达到平衡时浓度的范围为0mol/L<c(NH3)<0.3mol/L;若平衡时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L,如果反应是从反应物方向开始的,NH3的起始浓度为0mol/L,如果反应是生成物方向进行的,生成0.1mol/LN2时消耗NH3的浓度分别为0.05mol/L,NH3的起始浓度为0.15mol/L,NH3起始时浓度的范围为0mol/L≤c(NH3)≤0.3mol/L;
;正向移动;(2)若反应起始时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L,假设反应正向进行,则N2的最大转化浓度为0.1mol/L,则NH3的变化浓度为0.2mol/L,即平衡时NH3的浓度小于0.3mol/L,假设反应逆向进行,则NH3的变化浓度最大为0.1mol/L,即平衡时NH3的最小浓度为大于0mol/L,故NH3达到平衡时浓度的范围为0mol/L<c(NH3)<0.3mol/L;若平衡时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L,如果反应是从反应物方向开始的,NH3的起始浓度为0mol/L,如果反应是生成物方向进行的,生成0.1mol/LN2时消耗NH3的浓度分别为0.05mol/L,NH3的起始浓度为0.15mol/L,NH3起始时浓度的范围为0mol/L≤c(NH3)≤0.3mol/L;
所以答案是:0mol/L<c(NH3)<0.3mol/L;0mol/L≤c(NH3)≤0.3mol/L;(3)甲投入1molN2、3molH2 , 乙中投入2molNH3 , 则甲与乙是完全等效的,根据盖斯定律可知,甲与乙的反应的能量变化之和为92.4kJ,Q1+Q2=92.4;甲投入1molN2、3molH2 , 乙中投入2molNH3 , 则甲与乙是完全等效的,所以转化率α1+α2=1;丙容器反应物投入量4molNH3 , 是乙的二倍,若平衡不移动,丙中压强为乙的二倍;由于丙中相当于增大压强,平衡向着向着正向移动,所以丙中压强减小,小于乙的2倍,即2p2>p3;
所以答案是:92.4;=;>;(4)打开K2 , 一段时间又达到平衡时,等效为开始通入3molN2和9molH2再恒温恒容到达的平衡,与B中平衡为等效平衡,平衡时同种物质的转化率相等,则平衡时混合气体物质的量为B中平衡时的3倍,恒温恒压下体积之比等于物质的量之比,故平衡时气体体积为0.9 L×3=2.7L,则B的体积为2.7 L﹣1L=1.7L,
所以答案是:1.7.
【考点精析】认真审题,首先需要了解反应热和焓变(在化学反应中放出或吸收的热量,通常叫反应热),还要掌握化学平衡的计算(反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%)的相关知识才是答题的关键.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】已知32 g X与40 g Y恰好完全反应,生成m g Q和 9 g H,在相同条件下,16 g X和足量Y混合生成0.25 mol Q和若干摩的H,则物质Q的摩尔质量应是( )
A. 122 g·mol-1 B. 63 g·mol-1 C. 126 g·mol-1 D. 163 g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)═4NO(g)+6H2O(g) 在2L的密闭容器中进行,1分钟后,NH3减少了0.12mol,则平均每秒钟各物质浓度变化正确的是( )
A.NH3:0.002 molL﹣1
B.H2O:0.002 molL﹣1
C.NO:0.001 molL﹣1
D.O2:0.001 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率是化学反应原理的重要组成部分.请回答下列问题:
(1)已知一定条件下发生反应:2SO2(g)+O2(g)2SO3(g)△H<0,在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件). 
(2)探究反应条件对0.l0mol/L,Na2S2O3溶液与稀H2SO4反应速率的影响.其设计与测定结果如表:
编号 | 反应温度/℃ | Na2S2O3浓液/mL | 甲 | 0.1mol/LH2SO4溶液/mL | 乙 |
① | 25℃ | 10.0 | 0 | 10.0 | |
② | 25℃ | 5.0 | a | 10.0 | |
③ | 45℃ | 10.0 | 0 | 10.0 |
上述实验①③是探究对化学反应速率的影响;若上述实验①②是探究浓度对化学反应速率的影响,则表格中“甲”为 , a为;乙是实验需要测量的物理量,则表格中“乙”为 .
(3)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大. ①针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大.从影响化学反应速率的因素看,你猜想还可能是的影响.
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入(填字母序号).
A.硫酸钾B.氯化锰c.硫酸锰D.水.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列反应:
①、2H2O+Cl2+SO2=H2SO4+2HCl
②、 KMnO4+ HCl(浓)= KCl+__MnCl2+___Cl2↑+___H2O
针对上述两个反应回答:
(1)配平②的化学方程式________;
(2)用单线桥标出①中电子转移的方向和数目________;
(3)Cl2、SO2和KMnO4的氧化性强弱顺序为____;
(4)反应①中氧化产物和还原产物的物质的量之比为___;
(5)反应②中氯化氢表现出的性质是___。
A.还原性 B.酸性 C.氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。
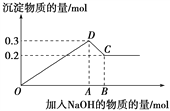
(1)写出代表各线段发生的反应的离子方程式:
OD段________________________________________________,
DC段________________________________________________。
(2)原溶液中Mg2+、Al3+的物质的量浓度之比为________。
(3)图中C点表示当加入______mol NaOH时,Al3+已经转化为_____,Mg2+已经转化为______。
(4)图中线段OA∶AB=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示某化学反应过程中,生成物的量与时间的关系,图中a、b、c三条曲线不能反映下列哪种因素对生成物的量的影响( )

A. 不同的温度 B. 不同的pH值
C. 不同的底物浓度 D. 不同的酶浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
X | Y | |
Z | W |
请回答下列问题:
(1)W位于周期表中第周期,第族;
(2)X可形成双原子分子,其分子的电子式是;Y和氢元素形成的10电子微粒中常见的+1价阳离子为(填化学式,下同);Z和氢元素形成的18电子微粒中常见的﹣1价阴离子为;
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2 , 该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式
(4)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡进有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com