
有关FeSO4的转化关系如图所示(部分物质已略去)。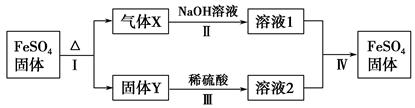
已知:①X由两种化合物组成,将X通入品红溶液,溶液退色;通入BaCl2溶液,产生白色沉淀。
②Y是红棕色的化合物。
(1)气体X的成分是(填化学式) 。
(2)反应Ⅰ的反应类型属于(填序号) 。
a.分解反应
B.复分解反应
c.置换反应
D.化合反应
e.氧化还原反应
(3)溶液2中金属阳离子的检验方法是 。
(4)若经反应Ⅰ得到16 g固体Y,产生的气体X恰好被0.4 L 1 mol·L-1 NaOH溶液完全吸收,则反应Ⅳ中生成FeSO4的离子方程式是 。
科目:高中化学 来源: 题型:填空题
(9分)有关物质间有下图所示的转化关系。其中:A的浓溶液与单质B在加热时才发生反应①;A的稀溶液与足量B发生反应②。据此填写下列空白: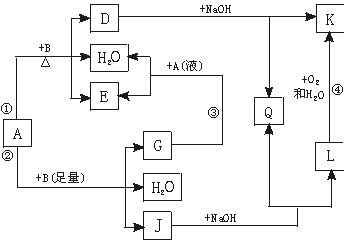
(1)反应④的现象是 。
(2)写出反应②的离子方程式 。
(3)根据题示信息判断,A的浓溶液和单质B加热时能否产生G,说明理由(写出化学方程式回答):
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
碳酸钠俗称纯碱,其用途很广。实验室中,用碳酸氢铵和饱和食盐水可制得纯碱。各物质在不同温度下的溶解度见表。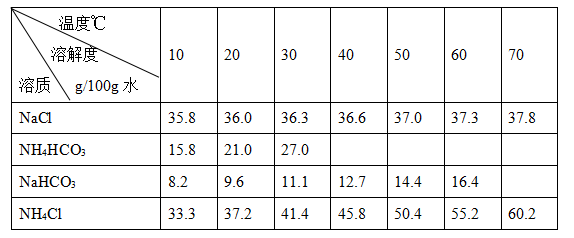
实验步骤
Ⅰ、化盐与精制:①粗盐(含Ca2+、Mg2+、SO42-)溶解;②加入足量NaOH和Na2CO3溶液,煮沸;③过滤;④加入盐酸调pH至7。
Ⅱ、转化:①将精制后的食盐溶液温度控制在30~35℃之间;在不断搅拌下,加入研细的碳酸氢铵;保温,搅拌半小时;②静置,a 、b ;③得到NaHCO3晶体。
Ⅲ、制纯碱:将得的NaHCO3放入蒸发皿中,在酒精灯上灼烧,冷却到室温,即得到纯碱。
完成下列填空:
(1)“化盐与精制”可除去的粗盐中的杂质离子是 。
(2)“转化”的离子方程式是 。
(3)“转化”过程中,温度控制在30~35℃之间的加热方式是 ;为什么温度控制在30~35℃之间? 。
(4)a、b处的操作分别是 、 。
(5)实验室制得的纯碱含少量NaCl还可能含少量NaHCO3,为测定纯碱的纯度,用电子天平准确称取样品G克,将其放入锥形瓶中用适量蒸馏水溶解,滴加2滴酚酞,用c mol/L的标准盐酸滴定至溶液由浅红色变成无色且半分钟不变,滴定过程中无气体产生,所用盐酸的体积为V1mL。此时发生的反应为:
CO32-+H+→HCO3-
①样品中碳酸钠质量百分含量的表达式是 。
②向锥形瓶溶液中继续滴加2滴甲基橙,用同浓度的盐酸继续滴定至终点,所用盐酸的体积为V2mL。滴定终点时溶液颜色的变化是 ;根据实验数据,如何判断样品含NaHCO3 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备无水AlCl3的流程如下: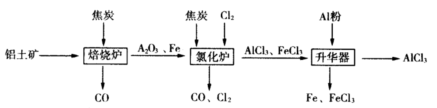
已知:AlCl3,FeCl3,分别在183℃、315℃升华
(1)在焙烧炉中发生反应:
①Fe2O3(s)+3C(s) 2Fe(s)+3CO(g) △H=-492.7kJ/mol
2Fe(s)+3CO(g) △H=-492.7kJ/mol
②3CO(g)+ Fe2O3(s) 2Fe(s)+3CO2(g) △H=+25.2kJ/mol
2Fe(s)+3CO2(g) △H=+25.2kJ/mol
反应2Fe2O3(s)+3C(s) 4Fe(s)+3CO2(g) △H=___________kJ/mol。
4Fe(s)+3CO2(g) △H=___________kJ/mol。
(2)①Al2O3,Cl2和C在氯化炉中高温下发生反应,当生成1molAlCl3时转移______mol电子;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为_______。在温度约为700℃向升华器中加入铝粉,发生反应的化学方程式为 。充分反应后温度降至_____以下(填“183℃、315℃之一),开始分离收集AlCl3。
②将AlCl3· 6H2O溶于浓硫酸进行蒸馏,也能得到一定量的无水AlCl3,此原理是利用浓硫酸下列性质中的 (填字母序号)。
①氧化性 ②吸水性 ③难挥发性 ④脱水性
a.只有① b.只有② c.只有②③ d.只有②③④
(3)海洋灯塔电池是利用铝、石墨为电极材料,海水为电解质溶液,构成电池的其正极反应式________,与铅蓄电池相比.释放相同电量时,所消耗金属电极材料的质量比m(Al): m(Pb)=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
单质A与粉末化合物B组成的混合物能发生如图所示的一系列反应: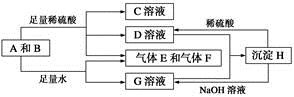
请回答下列问题:
(1)组成A单质的元素在周期表中处于第__________周期__________族。
(2)化合物B的电子式为_____________________________。
(3)D与G两溶液混合后发生反应的离子方程式为____________________
(4)常温下,D溶液的pH________7(填“>”、“<”或“=”),其原因是____________________________(用离子方程式表示)。
(5)10.8 g A单质与足量的NaOH溶液反应,消耗氧化剂的质量为________ g。
(6)用碳棒、稀硫酸、气体E和气体F组成燃料电池,该电池的正极反应式为______________________。以该电池为电源,用惰性电极电解100 g 8%的C溶液,电解到溶质的质量分数为12.5%时停止电解,则电解过程中,生成的气体在准状况下的体积共为________ L,电路上通过电子的物质的量为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为: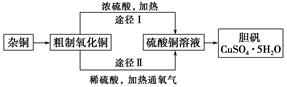
(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于 上(用以下所给仪器的编号填入,下同),取用坩埚应使用 ,灼烧后的坩埚应放在 上,不能直接放在桌面上。
实验所用仪器:
a.蒸发皿
b.石棉网
c.泥三角
d.表面皿
e.坩埚钳
f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,灼烧后含有少量铜的可能原因是 。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、 、冷却结晶、 、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是 、 。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行 次。
(6)若测定结果x值偏高,可能的原因是 (填字母编号)。
a.加热温度过高
b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却
d.胆矾晶体部分风化
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
纯碱(Na2CO3)在生产生活中具有广泛的用途。以下是实验室模拟制碱原理制取Na2CO3的流程图。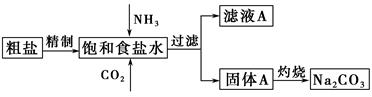
已知:向饱和食盐水中通入NH3、CO2后发生的反应为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。请回答以下问题:
(1)粗盐中含有的杂质离子有Ca2+、Mg2+、SO42-等。
精制除杂的步骤顺序是a→ → → →b(填字母编号)。
a.粗盐溶解,滤去沉渣
b.加入盐酸调pH
c.加入Ba(OH)2溶液
d.加入Na2CO3溶液
e.过滤
向饱和食盐水中先通入NH3,后通入CO2,理由是 。
(2)灼烧固体A制Na2CO3在 (填字母序号)中进行。
a.坩埚 b.蒸发皿 c.烧杯 d.锥形瓶
证明滤液A中含有NH4+的方法是 。
对滤液A进行重结晶能够获得NH4HCO3,向pH=13含Na+、K+的溶液中加入少量NH4HCO3使pH降低,反应的离子方程式为 。
(3)下图装置中常用于实验室制备CO2的是 (填字母编号);用b装置制备NH3,分液漏斗中盛放的试剂是 (填试剂名称),烧瓶内可加入的固体试剂是 (填试剂名称)。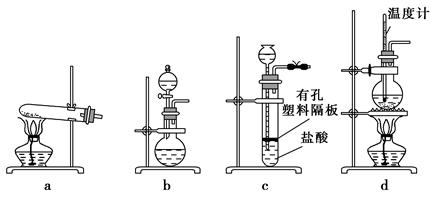
(4)一种天然碱晶体成分是aNa2CO3·bNa2SO4·cH2O,某同学利用下列提供的试剂,设计了如下简单合理测定Na2CO3的质量分数的实验方案。(仪器自选)请把实验方案填全:
供选择的试剂:1.0 mol·L-1 H2SO4溶液、1.0 mol·L-1 BaCl2溶液、稀氨水、碱石灰、Ca(OH)2溶液、蒸馏水
①称取m1g天然碱晶体样品,溶于适量蒸馏水中。
② 。
③ 。
④计算天然碱晶体中含Na2CO3的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下面是有关物质的转化关系图(有些物质已省略)。
若A为单质,E在常温下为液体,C的相对分子质量为78。请回答下列问题: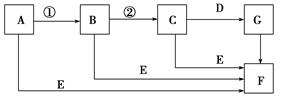
(1)画出A的原子结构示意图________,F的电子式是________。
(2)下面对C物质结构、性质的推断中,不正确的是________。
| A.久置于空气中会变成白色 |
| B.具有强氧化性 |
| C.晶体中存在离子键和共价键 |
| D.遇湿润的紫色石蕊试纸只能使其变蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D是中学化学常见的四种物质,它们的转化关系如下: A + B =" C" + D
(1)若A、B、C都是非金属氧化物,且C在空气中易变成A,则A中非氧元素的气态氢化物M的电子
式为 ;分子的稳定性B M(填“>”、“<”或“=”)
(2)若A、D是两种单质,B是黑色有磁性的氧化物,B与盐酸反应生成溶液N,检验N溶液中低价金属阳离子的方法是 。
将D的粉末加入溶液N中,当有28gD完全溶解时,该反应转移的电子是 mol。
(3)若A、B、C、D发生反应:2CO2(g) + 6H2(g) = CH3CH2OH(g) + 3H2O(g),根据下图所示信息,
①反应是 反应(填“放热”或“吸热”),判断依据是
②若△H =" a" KJ/mol,当消耗标况下5.6 L CO2时的反应热△H = KJ/mol。
③在恒温、恒容的密闭容器中,
下列描述能说明上述反应已达化学平衡状态的是 (填字母序号)。
A.生成1 mol CH3CH2OH的同时,生成3 mol H2O
B.容器中各组份的物质的量浓度不随时间而变化
C.容器中混合气体的密度不随时间而变化
D.容器中气体的分子总数不随时间而变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com