

分析 磷矿石粉碎后与硫酸反应生成磷酸和磷石膏,磷酸中通入氨气得磷铵溶液,磷铵溶液经过蒸发浓缩,冷却结晶得磷铵晶体,母液可以循环使用,磷石膏经过煅烧得水泥和二氧化硫窑气,净化后得二氧化硫,氧化后得三氧化硫,与水反应得硫酸,可以再参加与磷矿石的反应,(1)操作a是把固体与液体分开,应为过滤;未净化的SO2气体中有粉尘等杂质,可以使催化剂中毒;(2)装置a中磷酸与氨气发生反应,磷酸是三元酸,可以与氨气生成(NH4)3PO4、(NH4)2HPO4、NH4H2PO4;
(3)SO2、微量的SO3和酸雾都能与碱反应,不能利用碱测定,SO2具有还原性,可以利用强氧化剂测定;
(4)Fe2(SO4)3•x(NH4)2SO4•yH2O的摩尔质量为(304+132x+18y)g/mol,则2.410gFe2(SO4)3•x(NH4)2SO4•yH2O中含有的NH4+的物质的量n=$\frac{2.41}{400+132X+18Y}$×2xmol,加入过量的NaOH溶液并加热,生成的NH3的物质的量即=$\frac{2.41}{400+132X+18Y}$×2xmol,生成的氨气用100mL0.0500mol•L-1硫酸吸收,再用0.2000mol•L-1的NaOH溶液滴定,生成正盐时消耗NaOH溶液25.00mL,故NH3消耗的H+的物质的量n=0.1L×0.05mol/L×2-0.025L×0.2mol/L=0.05mol,据此列式①;
2.410gFe2(SO4)3•x(NH4)2SO4•yH2O中含有的SO42-的物质的量n=$\frac{2.41}{304+132x+18y}$×(3+x)mol,与BaCl2溶液反应生成白色BaSO4沉淀2.330g中所含的SO42-的物质的量相等,据此列式②,两式联立即可解得.
解答 解:(1)分离固体和液体的方法是过滤,即操作a的名称为过滤,未净化的SO2气体中有粉尘等杂质,可以使催化剂中毒,所以净化的目的是防止SO2气体中的灰尘、水蒸气等在接触室中导致催化剂中毒,
故答案为:过滤;防止SO2气体中的灰尘、水蒸气等在接触室中导致催化剂中毒;
(2)装置a中磷酸与氨气发生反应,磷酸是三元酸,可以生成(NH4)3PO4、(NH4)2HPO4、NH4H2PO4三种盐,其中(NH4)2HPO4、NH4H2PO4两种酸式盐.
故答案为:(NH4)2HPO4、NH4H2PO4;
(3)A、NaOH溶液与SO2、微量的SO3和酸雾反应,测量的SO2含量偏高,故A错误;
B、氨水NaOH溶液与SO2、微量的SO3和酸雾反应,测量的SO2含量偏高,故B错误;
C、硫酸尾气中只有SO2能被碘水氧化SO2,溶液颜色由蓝色变为无色,根据碘水溶液的体积结合方程式计算SO2的含量,故C正确;
D、硫酸尾气中只有SO2能被酸性KMnO4溶液氧化,溶液颜色由紫红色变为无色,根据KMnO4溶液的体积结合方程式计算SO2的含量,故D正确,
故选CD;
(4)Fe2(SO4)3•x(NH4)2SO4•yH2O的摩尔质量为(400+132x+18y)g/mol,则2.410gFe2(SO4)3•x(NH4)2SO4•yH2O中含有的NH4+的物质的量n=$\frac{2.41}{400+132X+18Y}$×2xmol,加入过量的NaOH溶液并加热,生成的NH3的物质的量n=$\frac{2.41}{400+132X+18Y}$×2xmol,生成的氨气用100mL0.0500mol•L-1硫酸吸收,再用0.2000mol•L-1的NaOH溶液滴定,生成正盐时消耗NaOH溶液25.00mL,故NH3消耗的H+的物质的量n=0.1L×0.05mol/L×2-0.025L×0.2mol/L=0.005mol,而根据反应NH3+H+=NH4+可知:$\frac{2.41}{400+132X+18Y}$×2xmol=0.005mol ①
2.410gFe2(SO4)3•x(NH4)2SO4•yH2O中含有的SO42-的物质的量n=$\frac{2.41}{400+132X+18Y}$×(3+x)mol,与BaCl2溶液反应生成白色BaSO4沉淀2.330g,而2.33gBaSO4沉淀中所含的SO42-的物质的量n=$\frac{2.33g}{233g/mol}$=0.01mol,故有:$\frac{2.41}{400+132X+18Y}$×(3+x)mol=0.01mol ②
将①②联立可解得:x=1,y=24
即该硫酸盐的化学式为Fe2(SO4)3•(NH4)2SO4•24H2O,
故答案为:Fe2(SO4)3•(NH4)2SO4•24H2O.
点评 本题考查了工业尾气的处理的方法和化学方程式的书写以及化学式的求解,综合性较强,难度较大.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 物质的量即物质的数量 | |
| B. | 物质的量是国际基本物理量之一 | |
| C. | 摩尔是一个物理量 | |
| D. | 1mol任何物质都含有6.02×1023个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果溶液变为蓝色,同时有紫红色固体出现,说明样品全部生成了Cu2O | |
| B. | 溶液中最终可能有紫红色固体出现 | |
| C. | 这种实验的结果无法说明CuO分解的程度 | |
| D. | 如果溶液中出现蓝色,最终没有紫红色固体出现,说明CuO没有分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:8 | B. | 32:21 | C. | 21:32 | D. | 21:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
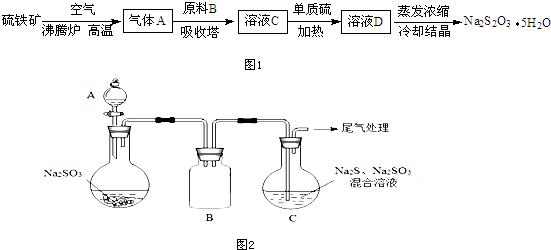
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D为气体 | B. | B的转化率为80% | ||
| C. | 5min时,c(A)=1.5mol•L-1 | D. | 反应开始前A的物质的量为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,在一容积不变的容器中,发生化学反应aA(g)+bB(g)═cC(g),采用不同比例的A,B作为起始物,测量反应达平衡时A和B的转化率,得到如图图象:
一定温度下,在一容积不变的容器中,发生化学反应aA(g)+bB(g)═cC(g),采用不同比例的A,B作为起始物,测量反应达平衡时A和B的转化率,得到如图图象:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在18g 16O2中含有NA个氧原子 | |
| B. | 16O与18O核外电子排布方式相同 | |
| C. | 在标准状况下,1.12L 16O2和1.12L 18O2均含有0.1NA个氧原子 | |
| D. | 18O2和16O2化学性质相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com