
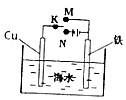
| A. | 电泳现象可证明胶体带电 | |
| B. | 如图装置,无论电键K接M还是接N,铁都能得到保护 | |
| C. | Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时,Fe+NO3-+4H+═Fe3++NO↑+2H2O | |
| D. | 由反应2Fe2++Br2═2Fe3++2Br-可知,将1molCl2通入含1molFeBr2的溶液中能发生反应的离子方程为;2Cl2+2Fe2++2Br-═2Fe3++Br2+4Cl- |
分析 A.胶体为中性,电泳现象可证明胶粒带电;
B.K接M时形成原电池,Fe为负极,负极Fe失去电子被氧化;
C.反应Fe+NO3-+4H+═Fe3++NO↑+2H2O中Fe与硝酸的物质的量之比为1:4;
D.亚铁离子优先反应,剩余的氯气再氧化溴离子.
解答 解:A.胶体不带电,但是可以吸附带电的离子形成带电的胶粒,在外加电场的作用下发生定向移动,故A错误;
B.K接N时为电解池的阴极,能够保护铁,但K接M时形成原电池,Fe为负极,负极铁放电,无法起到保护作用,故B错误;
C.Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:4时发生反应:Fe+NO3-+4H+═Fe3++NO↑+2H2O,n(Fe):n(HNO3)=3:8时发生反应:3Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O,所以当n(Fe):n(HNO3)=1:2时应该生成Fe3+和Fe2+,故C错误;
D.由反应2Fe2++Br2═2Fe3++2Br-可知,将1molCl2通入含1molFeBr2的溶液中,1mol亚铁离子完全反应消耗0.5mol氯气,剩余的0.5mol氯气能够氧化1mol溴离子,反应的离子方程式为:2Cl2+2Fe2++2Br-═2Fe3++Br2+4Cl-,故D正确;
故选D.
点评 本题考查较为综合,涉及氧化还原反应的计算、胶体性质、金属腐蚀与防护、离子方程式书写等知识,CD为易错点,根据反应物的量正确判断反应产物为解答关键,试题培养了学生的灵活应用能力.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16个纵行 | |
| B. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 | |
| C. | 除氦外的稀有气体原子的最外层电子数都是8 | |
| D. | 同一元素的各种同位素的化学性质相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子交换膜在工业上应用广泛,在氯碱工业中使用阳离子交换膜 | |
| B. | 食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用都是防止食品氧化变质 | |
| C. | 油脂和蛋白质是人体必需的营养物质,都属于高分子化合物 | |
| D. | 压缩天然气(CNG)、水煤气的主要成分是烃类,是城市推广的清洁燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
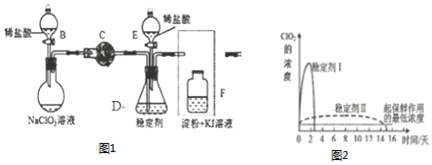
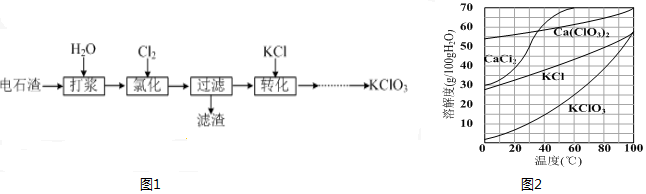
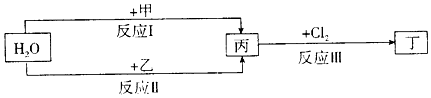
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23gNa与氧气充分燃烧,转移的电子数为NA | |
| B. | 1mol甲醇中含有的共价键数为4NA | |
| C. | 46gNO2和N2O4的混合气体含有的原子数为2NA | |
| D. | 标准状况下,22.4L氨水含有NH3分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
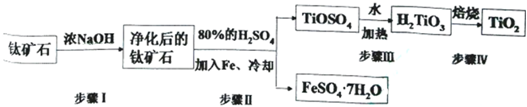
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加碘盐的溶液遇淀粉变蓝 | |
| B. | 汽油和柴油均为石油分馏得到的产品 | |
| C. | CaCO3可用作工业废气的脱硫剂 | |
| D. | 蔗糖、淀粉、蛋白质溶于水均能形成胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
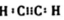 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com