
| A.加入AgNO3后,再加稀硝酸酸化,有白色沉淀产生,说明有Cl- |
| B.新制氯水使红玫瑰变为白玫瑰,说明有Cl2 |
| C.将KHCO3固体加入新制的氯水中,有气泡产生,说明有HClO |
| D.光照新制氯水有气泡逸出,该气体一定是Cl2 |
科目:高中化学 来源:不详 题型:单选题
| A.Ba(HS03)2 | B.BaS03 | C.BaS04 | D.BaS03和BaS04 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯水滴加到AgNO3溶液中会产生白色沉淀 |
| B.氯水通常应在阴凉处置于棕色细口瓶中密封保存 |
| C.新制氯水可使蓝色石蕊试纸先变红后褪色 |
| D.新制氯水放置数天后溶液的酸性减弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.CF4 | B.CH4 | C.NH4+ | D.H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


 证假设①。
证假设①。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
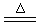 CuCl2 。在该反应中,
CuCl2 。在该反应中,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com