
 T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.
T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.分析 (1)根据图知,随着反应的进行,A、B的物质的量减小而C的物质的量增加,则A、B是反应物而C是生成物,达到平衡状态时△n(A)=(2.4-1.6)mol=0.8mol、△n(B)=(1.6-1.2)mol=0.4mol、△n(C)=(0.4-0)mol=0.4mol,同一时间段内各物质物质的量变化量之比与其计量数之比相等,据此确定方程式;
(2)反应达到平衡状态时,c(A)=$\frac{1.6mol}{2L}$=0.8mol/L、c(B)=$\frac{1.2mol}{2L}$=0.6mol/L、c(C)=$\frac{0.4mol}{2L}$=0.2mol/L,化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积之比;
(3)升高温度,化学平衡向吸热反应方向移动;
(4)0-4min内,A的平均反应速率=$\frac{\frac{△n(A)}{V}}{△t}$;
(5)达到平衡状态时,B的转化率=$\frac{0.4mol}{1.6mol}×100%$.
解答 解:(1)根据图知,随着反应的进行,A、B的物质的量减小而C的物质的量增加,则A、B是反应物而C是生成物,达到平衡状态时△n(A)=(2.4-1.6)mol=0.8mol、△n(B)=(1.6-1.2)mol=0.4mol、△n(C)=(0.4-0)mol=0.4mol,同一时间段内各物质物质的量变化量之比与其计量数之比相等,所以A、B、C的计量数之比=0.8mol:0.4mol:0.4mol=2:1:1,所以该反应方程式为2A+B?C,
故答案为:2A+B?C;
(2)反应达到平衡状态时,c(A)=$\frac{1.6mol}{2L}$=0.8mol/L、c(B)=$\frac{1.2mol}{2L}$=0.6mol/L、c(C)=$\frac{0.4mol}{2L}$=0.2mol/L,化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积之比,K=$\frac{0.2}{0.6×0.{8}^{2}}$=0.52,
故答案为:0.52;
(3)升高温度,化学平衡常数减小,化学平衡逆向移动,化学平衡向吸热反应方向移动,则正反应是放热反应,故答案为:放;
(4)0-4min内,A的平均反应速率=$\frac{\frac{△n(A)}{V}}{△t}$=$\frac{\frac{(2.4-2.0)mol}{2L}}{4min}$=0.05mol/(L.min),故答案为:0.05mol/(L.min);
(5)达到平衡状态时,B的转化率=$\frac{0.4mol}{1.6mol}×100%$=25%,故答案为:25%.
点评 本题考查图象分析,侧重考查学生分析计算能力,涉及转化率、反应速率、化学平衡常数的计算及外界条件对化学反应速率的影响,易错点是平衡常数计算.


科目:高中化学 来源: 题型:选择题
| A. | 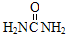 | B. | H2NCH2CH2NH2 | C. | (NH4)2CO3 | D. | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中一定含有Fe3+离子,不含Fe2+ | |
| B. | 原溶液中一定含有Fe2+离子,不含Fe3+ | |
| C. | 溶液中的Fe2+离子被氯气还原为Fe3+ | |
| D. | 溶液中同时含Fe2+或Fe3+离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原子序数依次增大的前四周期五种元素X、Y、Z、M、W.已知X的一种单质是原子晶体,且是自然界中最坚硬的物质,Y原子最外层电子数是次外层的3倍,M与Y同主族,且M元素的单质为淡黄色;Z与M同周期,且Z元素与Y元素可以形成两种化合物,其中一种化合物也为淡黄色;W是生活中使用最广泛的金属元素,且有+2和+3两种常见化合价.据此回答:
原子序数依次增大的前四周期五种元素X、Y、Z、M、W.已知X的一种单质是原子晶体,且是自然界中最坚硬的物质,Y原子最外层电子数是次外层的3倍,M与Y同主族,且M元素的单质为淡黄色;Z与M同周期,且Z元素与Y元素可以形成两种化合物,其中一种化合物也为淡黄色;W是生活中使用最广泛的金属元素,且有+2和+3两种常见化合价.据此回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L乙醇所含的分子数为NA | |
| B. | 1mol/LCaCl2溶液中含有的氯离子数目为2NA | |
| C. | 1 mol金属钠在足量氧气中完全燃烧转移的电子数为2NA | |
| D. | 28g N2中含有的原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 现象 | 结论 | |
| A | 稀硫酸滴入碳酸钠溶液中,将产生的气体通入盛有硅酸钠溶液的烧杯中 | 烧杯中产生白色胶状沉淀 | 非金属性:S>C>Si |
| B | 用铂丝蘸取少量某溶液进行焰色反应 | 火焰呈黄色 | 该溶液一定是钠盐溶液 |
| C | 将饱和氯化铁溶液滴入盛有沸水的烧杯中,继续煮沸至溶液呈红褐色,停止加热,用激光笔照射烧杯中的液体 | 看到一条光亮的“通路” | 证明生成了氢氧化铁沉淀 |
| D | 在分液漏斗中加入碘水后再加入CCl4,充分振荡、静置 | 分层,且上层溶液呈紫色 | CCl4可作为碘的萃取剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1834年,德国科学家米希尔里希通过蒸馏苯甲酸和石灰的混合物,得到了鱼法拉第所制液体相同的一种液体,并命名为苯.后来,法国化学家热拉尔等人又确定了苯的分子式为C6H6.
1834年,德国科学家米希尔里希通过蒸馏苯甲酸和石灰的混合物,得到了鱼法拉第所制液体相同的一种液体,并命名为苯.后来,法国化学家热拉尔等人又确定了苯的分子式为C6H6.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com