
| A. | C2H2含碳量最高,燃烧生成的CO2最多 | |
| B. | C2H2燃烧时火焰最明亮 | |
| C. | CH4含氢量最高,燃烧生成H2O最多 | |
| D. | CH4、C2H4燃烧生成H2O质量不同,消耗O2不同 |
分析 等物质的量的CH4、C2H4、C2H2,分别在足量的氧气中充分燃烧,1mol烃的耗氧量为(x+$\frac{y}{4}$)mol,有机物C原子数越多,生成二氧化碳越多,H原子数越多,生成水的量越多,以此解答该题.
解答 解:A.物质的量相同的烃,分子中C原子数目越多生成的二氧化碳越多,则等物质的量C2H4、C2H2燃烧生成二氧化碳相等,比等物质的量的甲烷生成的二氧化碳多,故A错误;
B.含碳量越高火焰越明亮,所以C2H2燃烧火焰最明亮,故B正确;
C.物质的量相同的烃,分子中H原子数目越多生成的水越多,则等物质的量的CH4、C2H4生成水的量相等,比等物质的量的乙炔生成的水多,故C错误;
D.根据H原子守恒,物质的量相等CH4、C2H4燃烧生成水的质量相同,故D错误.
故选B.
点评 本题考查烃燃烧的有关计算,为高频考点,侧重于学生的分析能力的考查,难度不大,注意把握有机物的组成以及燃烧的特点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 光照射甲烷和氯气的混合气体 | |
| B. | 乙烯通入溴水中 | |
| C. | 在镍作催化剂条件下,苯与氢气反应 | |
| D. | 苯与液溴混合后撒入铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
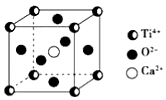 CaTiO3的晶体结构模型如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是( )
CaTiO3的晶体结构模型如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是( )| A. | CaTiO3的摩尔质量为136 | |
| B. | CaTiO3晶体中每个Ti4+与12个Ca2+紧相邻 | |
| C. | CaTiO3晶体中每个Ti4+与12个O2-紧相邻 | |
| D. | CaTiO3晶体中每个Ti4+与12个Ti4+紧相邻 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | B. | Cu(OH)2+2HCl═CuCl2+2H2O | ||
| C. | 2Na+2H2O═2NaOH+H2↑ | D. | 2Na2O2+2CO2═2Na2CO3+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HCO3-、ClO-、Na+、H+ | B. | Cl-、NH4+、NO3-、H+ | ||
| C. | K+、Cu2+、Cl-、SO42- | D. | OH-、Mg2+、Na+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将lL2mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA | |
| B. | 1L0.1mol/LNaHSO4溶液中含有0.1 Na个HSO4- | |
| C. | 常温常压下,23gNO2和N2O4的混合气体一定含有NA个氧原子 | |
| D. | lmol铁与足量稀盐酸反应转移的电子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10.7 | B. | 8.5 | C. | 32 | D. | 64 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)=c(HS-)+2c(S2-)+c(OH-) | |
| B. | c(H2S)+c(HS-)+c(S2-)=0.1 mol/L | |
| C. | 将上述溶液稀释至0.01 mol/L,c(H+)•c(OH-)不变 | |
| D. | c(S2-)+c(OH-)=c(H+)+c(H2S) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com