
 乙苯(
乙苯(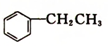 )在有机合成中占有重要的地位,有着广泛的用途.
)在有机合成中占有重要的地位,有着广泛的用途.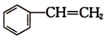 (g)+HCl(g)?
(g)+HCl(g)? (g)△H1=-54kJ•mol-1
(g)△H1=-54kJ•mol-1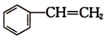 (g)+H2(g)?
(g)+H2(g)? (g)△H2=-121kJ•mol-1
(g)△H2=-121kJ•mol-1| 化学键 | C-H | C-C | C=C | C-Cl | H-Cl |
| 键能/(kJ•mol-1) | 412 | 348 | X | 341 | 432 |
 (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(g)△H4
(g)+HCl(g)△H4 (g)、2mol Cl2(g)、1mol
(g)、2mol Cl2(g)、1mol  (g)、2mol HCl(g),则开始时,v正=(填“>”、“<”或“=”)v逆.
(g)、2mol HCl(g),则开始时,v正=(填“>”、“<”或“=”)v逆. 分析 (1)反应②是气体体积减小的反应,缩小容器容积,压强增大反应速率增大,平衡向气体体积减小的方向进行;
(2)反应焓变△H=反应物的总键能-生成物的总键能;
(3)①
Ⅰ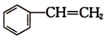 (g)+HCl(g)?
(g)+HCl(g)? (g)△H1=-54kJ•mol-1
(g)△H1=-54kJ•mol-1
Ⅱ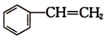 (g)+H2(g)?
(g)+H2(g)? (g)△H2=-121kJ•mol-1
(g)△H2=-121kJ•mol-1
ⅢH2(g)+Cl2(g)═2HCl(g),△H3=-185kJ•mol-1
依据盖斯定律Ⅰ-Ⅱ+Ⅲ得到 (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(g)及其焓变;
(g)+HCl(g)及其焓变;
②第一步计算可知该反应为放热反应,升温平衡逆向进行,平衡常数减小;
③T1°C正逆反应的平衡常数相同,正逆反应的平衡常数应互为倒数,判断正逆反应平衡常数为1,计算此时浓度商和平衡常数比较判断反应进行的方向.
解答 解:(1)②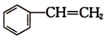 (g)+H2(g)?
(g)+H2(g)? (g)△H2=-121kJ•mol-1,反应②是气体体积减小的反应,缩小容器容积,压强增大反应速率增大,平衡向气体体积减小的方向进行,正向进行反应物转化率增大,
(g)△H2=-121kJ•mol-1,反应②是气体体积减小的反应,缩小容器容积,压强增大反应速率增大,平衡向气体体积减小的方向进行,正向进行反应物转化率增大,
故答案为:缩小容器容积反应速率加快,平衡正向进行,反应物转化率增大;
(2)①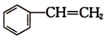 (g)+HCl(g)?
(g)+HCl(g)? (g)△H1=-54kJ•mol-1,
(g)△H1=-54kJ•mol-1,
反应焓变△H1=反应物的总键能-生成物的总键能=-54KJ/mol=xKJ/mol+348KJ/mol+432KJ/mol-412KJ/mol-341KJ/mol,x=615,
故答案为:615;
(3)①
Ⅰ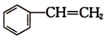 (g)+HCl(g)?
(g)+HCl(g)? (g)△H1=-54kJ•mol-1
(g)△H1=-54kJ•mol-1
Ⅱ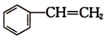 (g)+H2(g)?
(g)+H2(g)? (g)△H2=-121kJ•mol-1
(g)△H2=-121kJ•mol-1
ⅢH2(g)+Cl2(g)═2HCl(g),△H3=-185kJ•mol-1
依据盖斯定律Ⅰ-Ⅱ+Ⅲ得到 (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(g)△H4=△H1-△H2+△H3=-118KJ/mol,
(g)+HCl(g)△H4=△H1-△H2+△H3=-118KJ/mol,
故答案为:118KJ/mol;
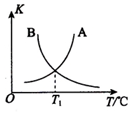
②第一步计算可知该反应为放热反应,升温平衡逆向进行,平衡常数减小,图象中判断可知表示正反应平衡常数K正的曲线为B,正反应平衡常数为A,
故答案为:B;反应正反应为放热反应,升温平衡逆向进行平衡常数减小;
③T1°C正逆反应的平衡常数相同,正逆反应的平衡常数应互为倒数,判断正逆反应平衡常数为1,起始向容积为10L的容积可变的密闭容器中充入1mol  (g)、2mol Cl2(g)、1mol
(g)、2mol Cl2(g)、1mol  (g)、2mol HCl(g),计算此时浓度商Qc=$\frac{0.2×0.1}{0.2×0.1}$=1=K,说明此时反应达到平衡状态,则开始时,v正=v逆,故答案为:=.
(g)、2mol HCl(g),计算此时浓度商Qc=$\frac{0.2×0.1}{0.2×0.1}$=1=K,说明此时反应达到平衡状态,则开始时,v正=v逆,故答案为:=.
点评 本题考查了好像平衡常数的计算和影响因素分析判断,主要是盖斯定律计算、焓变与键能的计算等,掌握基础是解题关键,题目难度中等.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸雨是指pH值小于7的天然降水 | |
| B. | 酸雨中的主要溶质是SO2 | |
| C. | 酸雨的形成过程中不可能出现SO3 | |
| D. | 工业上大量燃烧含硫燃料是酸雨的成因 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中$\frac{c(M{g}^{2+})}{c(M{n}^{2+})}$=$\frac{1}{100}$ | |
| B. | 若加入少量NaOH,Ksp[Mg(OH)2]和Ksp[Mn(OH)2]均减小 | |
| C. | 若加入少量MgCl2,溶液中c(Mg2+)和c(Mn2+)均增大 | |
| D. | 若升高温度,Mg(OH)2和Mn(OH)2两种固体的质量均不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X<Y<Z<W | |
| B. | 最简单氢化物的稳定性:Y>W | |
| C. | Z分别与Y、W组成的化合物中化学键类型均相同 | |
| D. | 粘有W的单质的试管可用酒精洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ge(32号元素)的单晶可以作为光电转换材料用于太阳能电池 | |
| B. | 交警检查司机是否酒后驾车的原理中体现了乙醇的还原性 | |
| C. | 在家用电热水器不锈钢内胆镶嵌镁棒,以防止内胆被腐蚀 | |
| D. | 施用适量石灰乳可降低盐碱地(含较多NaCl、Na2CO3)的碱性 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都市高一上10月月考化学试卷(解析版) 题型:选择题
甲柜 | 乙柜 | 丙柜 | 丁柜 | 戊柜 |
盐酸、硫酸 | 烧碱、氢氧化钡 | 硫、红磷 | 铜、锌 | 碳酸钠、硝酸钾 |
现在新购进硝酸、苛性钾、碘和硝酸银溶液,下列对其保存方法不正确的是( )
A.硝酸装进棕色细口瓶放在甲柜 B.苛性钾固体用磨口玻璃塞广口瓶放在乙柜
C.碘单质用广口瓶装放在丙柜 D.硝酸银溶液用棕色磨口细口瓶放在戊柜
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 应用 | 解释 |
| A | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | 其作用是吸收水果释放出的乙烯 |
| B | 在入海口的钢铁闸门上装一定数量的锌块防止闸门被腐蚀 | 利用外加电流的阴极保护法保护金属 |
| C | 高铁车厢采用铝合金材料 | 铝与氧气不反应 |
| D | 高纯硅作计算机芯片的材料 | 硅晶体在自然界中能稳定存在 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅胶可用作食品的抗氧化剂 | |
| B. | 可用热碱水清洗炊具上的油渍 | |
| C. | 铁表面镀锌可增强其抗腐蚀性 | |
| D. | 大量燃烧化石燃料是导致雾霾天气的重要因素之一 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com