
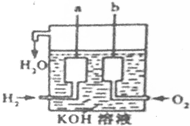
 (1)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:a、b两个电极均由多孔的碳块组成.写出b极的电极反应方程式.工作时电池负极区的pH减小(填“增大”、“减小”或“不变”).
(1)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:a、b两个电极均由多孔的碳块组成.写出b极的电极反应方程式.工作时电池负极区的pH减小(填“增大”、“减小”或“不变”).分析 (1)氢氧燃料电池中,通入氢气的一极为电源的负极,发生氧化反应,电极反应式为H2-2e-+2OH-=2H2O,通入氧气的一极为原电池的正极,电极反应式为O2+4e-+2H2O=4OH-,原电池工作时,氢氧燃料电池的总反应为2H2+O2=2H2O;
(2)在2H2+O2=2H2O中,根据2H2O~4mole-计算.
解答 解:(1)氢氧燃料电池中,通入氢气的一极a为电源的负极,通入氧气的一极b为原电池的正极,由于电解质溶液呈碱性,则负极a电极反应式为2H2-4e-+4OH-=4H2O(或H2-2e-+2OH-=2H2O),氢氧根被消耗,碱性减弱,PH值减小;正极b的电极反应式为O2+4e-+2H2O=4OH-,
故答案为:O2+4e-+2H2O=4OH-;减小;
(2)氢氧燃料电池的总反应与氢气在氧气中燃烧的化学方程式相同,生成物为水,即2H2+O2=2H2O,在2H2+O2=2H2O中,2H2O~4mole-,当为飞行员提供了9kg水,物质的量为:$\frac{9000g}{18g/mol}$=500mol,会转移电子1000mol,即1000NA,
故答案为:1000NA.
点评 本题考查原电池中的氢氧燃料电池的工作原理,题目难度不大,注意电极方程式的书写以及电解质溶液的酸碱性.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| A. | 氧化剂与还原剂的物质的量之比为 8﹕3 | |
| B. | 氧化剂与还原剂的物质的量之比为 3﹕8 | |
| C. | 若有 1 mol NO 气体生成,转移的电子总数为 6 mol | |
| D. | 反应的离子方程式为 CuS+2H++2NO3-═Cu2++2NO↑+SO42-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含氮、磷的污水任意排放会污染水体,导致水华、赤潮等 | |
| B. | 油脂能增加食物的滋味,增进食欲,保证机体的正常生理功能 | |
| C. | 利用高纯单质硅的半导体性能,可以制成光电池 | |
| D. | 纤维素和淀粉是同分异构体,在人体内均可水解成葡萄糖为人体提供能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ③④⑤ | C. | ①②④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速率等于逆反应速率 | B. | 反应物和生成物浓度不再发生变化 | ||
| C. | 正、逆反应速率都为零 | D. | 反应体系中混合物的组成保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com