
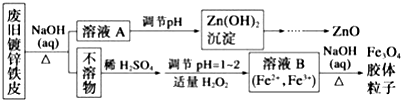
分析 废旧镀锌铁皮加入氢氧化钠溶液中反应,锌溶解生成偏锌酸钠和氢气,铁不溶解,过滤得到滤液A为Na2ZnO2,调节溶液PH生成氢氧化锌沉淀,过滤、洗涤、灼烧得到氧化锌,不溶物为铁,溶于稀硫酸加入适量过氧化氢,调节溶液PH=1~2,部分氧化亚铁离子为铁离子,得到含Fe2+、Fe3+的B溶液,加热促进水解生成四氧化三铁胶体粒子,
(1)根据原电池原理,镀锌铁皮的镀层破损后构成原电池,铁做正极,锌做负极,据此分析;
(2)Zn(OH)2具有两性,能溶于强碱;
(3)酸性条件下H2O2能将亚铁离子氧化成铁离子,根据电荷守恒和元素守恒书写反应的离子方程式;
(4)持续通入N2,防止Fe2+被氧化;Fe3O4胶体粒子能透过滤纸;
(5)根据m=cVM计算m(K2Cr2O7);根据溶液浓度的精度,应选择电子天平用于称量固体质量,烧杯用于溶解固体,玻璃棒用于搅拌和引流操作,250mL容量瓶用于配置溶液,胶头滴管用于加水定容;
(6)在酸性条件下K2Cr2O7将 Fe2+氧化为 Fe3+,还原产物为 Cr3+,根据电荷守恒和元素守恒书写反应的离子方程式;
解答 解:废旧镀锌铁皮加入氢氧化钠溶液中反应,锌溶解生成偏锌酸钠和氢气,铁不溶解,过滤得到滤液A为Na2ZnO2,调节溶液PH生成氢氧化锌沉淀,过滤、洗涤、灼烧得到氧化锌,不溶物为铁,溶于稀硫酸加入适量过氧化氢,调节溶液PH=1~2,部分氧化亚铁离子为铁离子,得到含Fe2+、Fe3+的B溶液,加热促进水解生成四氧化三铁胶体粒子,
(1)根据原电池原理,镀锌铁皮的镀层破损后构成原电池,锌比铁活泼,镀层破损后,锌由于做原电池的负极,保护铁不被腐蚀,
故答案为:锌比铁活泼,镀层破损后,锌由于做原电池的负极,保护铁不被腐蚀;
(2)Zn(OH)2具有两性,能溶于强碱,调节溶液A的pH不能太大,可产生,pH太大Zn(OH)2沉淀会溶解,
故答案为:否;
(3)酸性条件下H2O2能将亚铁离子氧化成铁离子,反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O,
故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;
(4)持续通入N2,防止Fe2+被氧化;Fe3O4胶体粒子能透过滤纸,所以不能用过滤的方法实现固液分离,
故答案为:在N2气氛下,防止Fe2+被氧化;不能;胶体粒子太小,抽滤时容易透过滤纸;
(5)m(K2Cr2O7)=0.01000mol•L-1×0.250 L×294.0 g•mol-1=0.7350g;
根据溶液浓度的精度,应选择电子天平用于称量固体质量,烧杯用于溶解固体,玻璃棒用于搅拌和引流操作,250mL容量瓶用于配置溶液,胶头滴管用于加水定容,故用不到的仪器为试管和漏斗,故选③⑤,还需要的玻璃仪器有250mL容量瓶,
故答案为:0.7350;③⑤;250mL容量瓶;
(6)在酸性条件下K2Cr2O7将 Fe2+氧化为 Fe3+,还原产物为 Cr3+,反应的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O.
点评 本题以“废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO”为载体,考查实验基本操作和技能,涉及标准溶液的配制及滴定的误差分析、对信息的利用、实验条件的控制等,试题难度中等,是对学生综合能力的考查,需要学生基本知识的基础与分析问题、解决问题的能力.


 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H3PO4的摩尔质量为98 | |
| B. | 阿伏伽德罗常数即为0.012kg12C所含的碳原子数 | |
| C. | 任何气体的摩尔体积均约为22.4L.mol-1 | |
| D. | 一个标准大气压下4℃时,9mL水中所含电子数约为3.01×1024. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
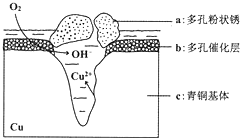 如图所示为青铜器在潮湿环境中发生的电化学腐蚀的示意图,下列说法错误的是( )
如图所示为青铜器在潮湿环境中发生的电化学腐蚀的示意图,下列说法错误的是( )| A. | 腐蚀过程中,铜被氧化 | |
| B. | 已知环境中的 Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔铜锈Cu2(OH)3Cl,则其离子方程式为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓ | |
| C. | 若生成 4.29 g Cu2(OH)3Cl,则理论上耗氧体积定为 0.448 L | |
| D. | 正极的电极反应式为:O2+4e-+2H2O=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| B. | 碘是人体必需微量元素,国家规定食盐必须加碘.故炒菜时应在菜快出锅时放盐比较好 | |
| C. | 单质硅常用做光导纤维的材料,这与硅的半导体性能有一定关系 | |
| D. | 高压钠灯发出的黄光射程远、透雾能力强,常用做路灯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
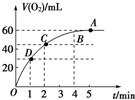 将0.1mol MnO2粉末加入到50mL过氧化氢溶液(H2O2,ρ=1.1g/mL)中,在标准状况下放出气体的体积和时间的关系如图所示.
将0.1mol MnO2粉末加入到50mL过氧化氢溶液(H2O2,ρ=1.1g/mL)中,在标准状况下放出气体的体积和时间的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L乙醇中含有的碳氢键数为2.5NA | |
| B. | 常温常压下,28gC2H4、CO的混合气体中含有碳原子的数目为1.5NA | |
| C. | 常温下,20LpH=12的Na2CO3溶液中含有的OH-离子数为0.2NA | |
| D. | 标准状况下,2.24LCl2与足量的NaOH溶液反应,转移的电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加压有利于化学平衡向正反应方向移动 | |
| B. | 该反应的化学平衡常数表达式为:K=$\frac{{c}^{2}{N}_{2}{H}_{4}×{c}^{2}N{O}_{2}}{{c}^{3}{N}_{2}×{c}^{4}{H}_{2}O}$ | |
| C. | 升高温度可缩短反应达平衡的时间但不能提高平衡转化率 | |
| D. | 使用催化剂可缩短反应达平衡的时间但不能提高平衡转化率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com