
| A. | 将“地沟油”制成肥皂,可以提高资源的利用率 | |
| B. | 金属钠、金属镁等活泼金属着火时,可以使用泡沫灭火器来灭火 | |
| C. | 我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 | |
| D. | 推广以植物秸秆为原料的综合利用技术,避免焚烧秸秆造成空气污染 |
分析 A.地沟油是油脂,在碱溶液中水解生成高级脂肪酸钠和甘油,利用高级脂肪酸钠制备肥皂提高资源的利用率;
B.金属钠、镁是一种活泼金属,用来灭火的物质和金属钠以及钠燃烧后的产物之间不能反应;
C.特种钢缆是金属材料;
D.推广以植物秸秆为原料的综合利用技术,避免焚烧秸秆造成空气污染.
解答 解:A.地沟油是油脂,在碱溶液中水解生成高级脂肪酸钠和甘油,利用高级脂肪酸钠制备肥皂提高资源的利用率,符合资源利用,故A正确;
B.沫灭火器产生的二氧化碳能与钠燃烧后的产物过氧化钠产生氧气,氧气能助燃;泡沫灭火器产生的二氧化碳能与镁反应产生氧化镁和碳,所以金属钠、镁等活泼金属着火时,不能使用泡沫灭火器来灭火,应用沙子扑灭,故B错误;
C.舰载机降落的拦阻索是特种钢缆,主要是铁的合金属于金属材料,故C正确;
D.推广以植物秸秆为原料的综合利用技术,减少污染气体排放,避免焚烧秸秆造成空气污染,故D正确;
故选B.
点评 本题考查化学与生产、生活的关系,题目难度不大,要求学生能够用化学知识解释化学现象,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 1.0mol/L的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、[Al(OH)4]-、Cl- | |
| C. | pH=12的溶液:K+、Na+、CH3COO-、Br- | |
| D. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL1mol/L氯化镁溶液 | B. | 450mL1.5 mol/L氯酸钾溶液 | ||
| C. | 50mL1.5 mol/L氯化钾溶液 | D. | 50mL0.5 mol/L氯化铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2L氮气所含的原子数目为NA | |
| B. | 1.7g氨气所含分子数目为0.1NA | |
| C. | 1L 1mol•L-1的Na2SO4溶液中含有Na+的个数为NA | |
| D. | 2g氢气所含氢原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3和SO3溶于水后能导电,故KClO3和SO3均为电解质 | |
| B. | 升高温度能够增大单位体积内活化分子百分数,从而加快反应速率 | |
| C. | 中和热测定实验中需要用到的玻璃仪器有烧杯、温度计和量筒三种 | |
| D. | 强电解质的导电能力一定比弱电解质强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
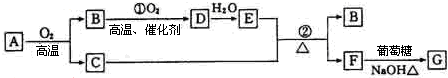
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的锌粉和锌片与相同体积、相同浓度的盐酸反应,反应速率相等 | |
| B. | 氢气与氮气能够缓慢地反应生成氨气,使用合适催化剂可以提高化学反应的转化率 | |
| C. | 用铁片与硫酸制备氢气时,滴加CuSO4溶液可以加快产生氢气的速率 | |
| D. | 二氧化硫的催化氧化反应的△H<0,所以升高温度,反应速率减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若水的体积与浓硫酸的体积比为3:1,稀释后溶液的物质的量浓度为4.6mol•L-1 | |
| B. | 若水的体积与浓硫酸的体积比为3:1,稀释后溶液中溶质质量分数为24.5% | |
| C. | 若水的体积与浓硫酸的质量之比为3:1,稀释后溶液的物质的量浓度为4.6mol•L-1 | |
| D. | 若水的质量与浓硫酸的质量比为3:1,稀释后溶液溶质质量分数为24.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁片置于硫酸铜溶液中有铜析出 | |
| B. | 铁、铜和氯气反应分别生成FeCl3和CuCl2 | |
| C. | 足量的铁粉和铜粉与浓硫酸反应生成FeSO4和CuSO4 | |
| D. | 铜片置于FeCl3溶液中铜片逐渐溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com