


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.①④③② | B.④③①② | C.④②③① | D.②①③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 混合物 | 试剂 | 分离方法 |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 溴乙烷(乙醇) | 蒸馏水 | 分液 |
| D | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 蒸馏 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
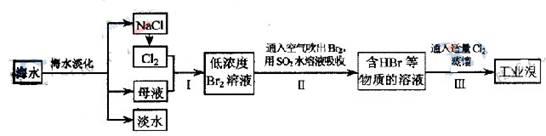
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.BaCl2溶液、Ba(NO3)2溶液、Na2CO3溶液 |
| B.NaCl溶液、Ba(NO3)2溶液、Na2CO3溶液 |
| C.KCl溶液、 Ba(NO3)2溶液、MgCl2溶液 |
| D.NaCl溶液、K2CO3溶液、Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溴水和碘水(淀粉溶液) |
| B.硫酸铵与氯化铵(采用加碱加热闻其气味的方法) |
| C.NaCl与KCl(采用灼烧观察焰色的方法) |
| D.K2CO3与KNO3(采用加盐酸观察其是否有气泡产生的方法) |
查看答案和解析>>
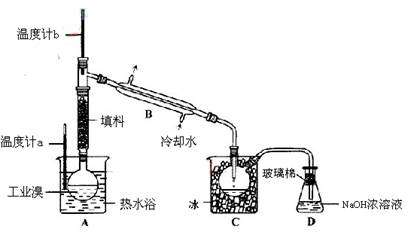
科目:高中化学 来源:不详 题型:实验题

 中填写所使用除杂试剂的化学式__________,在( )中的操作名称是____ ___。
中填写所使用除杂试剂的化学式__________,在( )中的操作名称是____ ___。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题



 【材料二】我国实际工业利用海带制取碘,采用的是离子交换法,其流程如下:
【材料二】我国实际工业利用海带制取碘,采用的是离子交换法,其流程如下:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com