
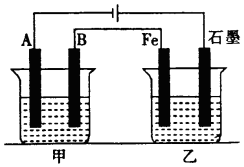
 如图所示,甲、乙为相互串联的两电解池,甲池利用电解原理在铁上镀银,一段时间后,甲池阴极增重43.2g,乙中盛放足量的CuSO4溶液,请回答(1)~(3)小题:
如图所示,甲、乙为相互串联的两电解池,甲池利用电解原理在铁上镀银,一段时间后,甲池阴极增重43.2g,乙中盛放足量的CuSO4溶液,请回答(1)~(3)小题:分析 根据图示可知,A为阴极,B为阳极,Fe为阴极,石墨为阳极.
(1)根据甲池利用电解原理在铁上镀银,据此分析A和B的电极材料;
(2)由于乙池中石墨为阳极,是惰性电极,而乙中盛放足量的CuSO4溶液,故在阳极上放电的是氢氧根,据此写出电极方程式;
(3)甲池阴极增重43.2g,增重的是银的质量,据此求出银的物质的量,然后根据Ag+放电反应为:Ag++e-=Ag,即可求出流经电极的电子的物质的量,然后根据乙池中只有阳极放出气体,且反应为4OH--4e-=2H2O+O2↑,据此分析计算.
解答 解:根据图示可知,A为阴极,B为阳极,Fe为阴极,石墨为阳极.
(1)由于A为阴极,B为阳极,而甲池要利用电解原理在铁上镀银,故银应做阳极,铁做阴极,即A的电极材料为铁,B的电极材料为银,故答案为:铁;银;
(2)由于乙池中阳极为石墨,故是阴离子放电,而乙中盛放足量的CuSO4溶液,故在阳极上放电的是氢氧根,故电极方程式为4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
(3)甲池阴极上Ag+放电,故增重43.2g是银的质量,物质的量为0.4mol,设阴极上得电子为xmol,根据Ag+放电反应可知:
Ag++e-=Ag
1 1
xmol 0.4mol
则有:$\frac{1}{xmol}=\frac{1}{0.4mol}$,
解得x=0.4mol
故乙池中两个电极上流经电子的物质的量为0.4mol,而只有阳极上有气体放出,且电极反应为:4OH--4e-=2H2O+O2↑,设生成的氧气的物质的量为ymol,则有:
4OH--4e-=2H2O+O2↑
4 1
0.4mol ymol
则有:
$\frac{4}{0.4mol}=\frac{1}{ymol}$
解得y=0.1mol
则体积V=nVm=0.1mol×22.4L/mol=2.24L.
故答案为:2.24L.
点评 本题为电化学知识的综合应用,题目难度中等,注意隔绝各电极上得失电子的数目相等来计算.做题时要正确写出电极方程式,准确判断两极上离子的放电顺序,侧重于考查学生的分析能力和计算能力.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:推断题
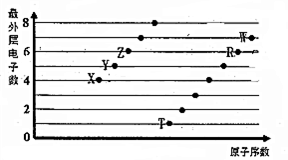 部分短周期元素原子最外层电子数与原子序数的关系如图,回答下列问题:
部分短周期元素原子最外层电子数与原子序数的关系如图,回答下列问题: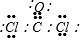 ;已知1mol XZW2与4mol NaOH
;已知1mol XZW2与4mol NaOH查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu+2Na+ | |
| B. | 稀H2SO4和Ba(OH)2溶液反应:H++SO42-+Ba2++OH-═BaSO4+H2O | |
| C. | 少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O═2C6H5OH+SO32- | |
| D. | 醋酸钠的水解反应:CH3COO-+H3O+═CH3COOH+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
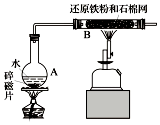 某校化学小组学生利用如图所列装置进行“铁与水反应”的实验.(图中夹持及尾气处理装置均已略去)
某校化学小组学生利用如图所列装置进行“铁与水反应”的实验.(图中夹持及尾气处理装置均已略去)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
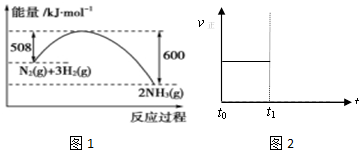
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制0.1mol/LNaCl溶液,定容时不小心加水超过刻度线,立即将水吸出 | |
| B. | 实验室制取氧气并用排水法收集,出现倒吸现象,立即停止加热 | |
| C. | 少量浓硫酸沾在皮肤上,立即用大量水冲洗,并涂上稀NaOH溶液 | |
| D. | 使用分液漏斗萃取碘水中的碘,振荡过程中要适时打开活塞进行“放气” |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
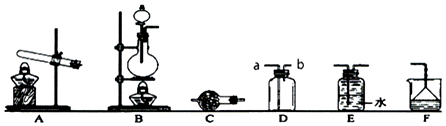
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 硼晶体的结构单元 | SF6分子 | S8分子 | NaCl | |
| 结构模型示意图 |  | 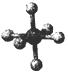 |  |  |
| 备注 | 熔点187K | 易溶于CS2 |
| A. | 单质硼属分子晶体,其结构单B12中含有30个B-B键,含20个正三角形 | |
| B. | SF6是由极性键构成的极性分子 | |
| C. | 固态硫S8属于原子晶体 | |
| D. | NaCl晶体中每个Na+周围距离最近的Na+有6个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com