

| A. | 用右图所示方法可保护钢闸门不被腐蚀 | |
| B. | SiO2(s)+2C(s)═Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H>0 | |
| C. | 常温下,NH4Cl溶液加水稀释,$\frac{{c(N{H_3}•{H_2}O)•c({H^+})}}{{c(N{H_4}^+)}}$增大 | |
| D. | C(s)+H2O(g)?CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 |
分析 A、保护钢闸门不被腐蚀,应让钢闸门做原电池的正极或电解池的阴极;
B、△H-T△S>0反应非自发进行,反应△S>0,△H>0;
C、盐的水解平衡常数Kh只受温度的影响;
D、升高温度,正、逆反应速率都增大;
解答 解:A、保护钢闸门不被腐蚀,应让钢闸门做原电池的正极或电解池的阴极,而此图中钢闸门做了原电池的负极,腐蚀速率会加快,故A错误;
B、△H-T△S>0,反应非自发进行,反应△S>0,满足△H-T△S>0,则△H>0,故B正确;
C、铵根离子的水解平衡常数Kh=$\frac{{c(N{H_3}•{H_2}O)•c({H^+})}}{{c(N{H_4}^+)}}$只受温度的影响,与其他任何因素无关,故常温加水稀释,Kh值不变,故C错误;
D、升高温度,正、逆反应速率都增大,正反应速率增大更多,平衡向正反应方向移动,故D错误;
故选B.
点评 本题考查金属的腐蚀与防护、水解平衡常数的影响因素,题目难度不大,本题把握外界条件对平衡常数的影响.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | PM2.5表示每立方米空气中直径小于或等于2.5μm的颗粒物的含量,PM2.5值越高,大气污染越严重,因此由PM2.5引起的雾霾一定属于胶体 | |
| B. | 分光光度计可用于分析溶液颜色与反应物(或生成物)浓度的关系,从而确定化学反应速率 | |
| C. | 对“地沟油”加工处理可以达到变废为宝的目的,比如对“地沟油”进行分馏可以制得汽油、煤油 | |
| D. | 次氯酸和臭氧都是强氧化剂,都能杀死水中的细菌.自来水常用氯气来杀菌消毒,是因为氯气杀菌消毒效果要比臭氧好,且不会残留有毒、有害物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
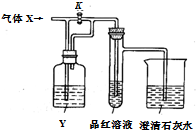 如图是检验气体性质的实验装置.向装置中缓慢通入气体X,若关闭活塞K,品红溶液无变化、澄清石灰水变浑浊;若打开活塞K,品红溶液褪色.据此判断,气体X和液体Y可能是( )
如图是检验气体性质的实验装置.向装置中缓慢通入气体X,若关闭活塞K,品红溶液无变化、澄清石灰水变浑浊;若打开活塞K,品红溶液褪色.据此判断,气体X和液体Y可能是( )| 选项 物质 | A | B | C | D |
| X | H2S | SO2 | CO2 | Cl2 |
| Y | 浓硫酸 | NaHCO3饱和溶液 | Na2SO3 溶液 | NaHSO3 溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液:NH4+、Ca2+、NO3-、SO42- | |
| B. | c(OH-)=1×10-13 mol•L-1的溶液:Na+、K+、ClO-、SO42- | |
| C. | 0.1 mol•L-1 FeCl2溶液:K+、Na+、SO42-、NO3- | |
| D. | 0.1 mol•L-1 KMnO4溶液:Na+、Mg2+、NO3-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | B中含有的官能团为羟基 | B. | 可用碳酸钠溶液区别B、D | ||
| C. | D中含有C═O键,E的名称为乙酸乙酯 | D. | B+D→E反应的装置如图 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
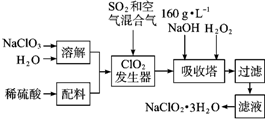 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.如图是过氧化氢法生产亚氯酸钠的工艺流程图:
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.如图是过氧化氢法生产亚氯酸钠的工艺流程图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com