
| A. | 2CH4(g)+4O2(g)→2CO2(g)+4H2O(1);△H=+890kJ•mol-1 | |
| B. | CH4(g)+2O2(g)→CO2(g)+2H2O(1);△H=+445kJ•mol-1 | |
| C. | CH4(g)+2O2(g)→CO2(g)+2H2O(1);△H=+890kJ•mol-1 | |
| D. | $\frac{1}{2}$CH4(g)+O2(g)=$\frac{1}{2}$CO2(g)+H2O(1);△H=-445kJ•mol-1 |
分析 0.5mol CH4完全燃烧生成 CO2和 液态水时,放出 445kJ热量,可知1mol CH4完全燃烧生成 CO2和 液态水时,放热为890kJ/mol,结合物质的状态、焓变为负来解答.
解答 解:0.5mol CH4完全燃烧生成 CO2和 液态水时,放出 445kJ热量,可知1mol CH4完全燃烧生成 CO2和 液态水时,放热为890kJ/mol,则热化学方程式为$\frac{1}{2}$CH4(g)+O2(g)=$\frac{1}{2}$CO2(g)+H2O(1)△H=-445kJ•mol-1,或CH4(g)+2O2(g)=CO2(g)+2H2O(1)△H=-890kJ•mol-1,
故选D.
点评 本题考查热化学方程式的书写,为高频考点,把握物质的量与热量的关系、热化学方程式的书写方法为解答的关键,侧重分析与应用能力的考查,焓变的正负,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 转化①有利于碳参与自然界的元素循环 | |
| B. | 转化②中S和O2属于不同的核素 | |
| C. | 可用澄清的石灰水鉴别CO2与SO2 | |
| D. | 转化的热化学方程式是:2CO(g)+SO2(g)═S(s)+2CO2 (g)△H=+270kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 CO2+4HCl.
CO2+4HCl.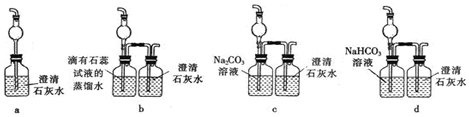
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
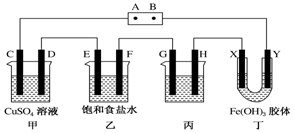
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下,11.2L 氟化氢中含有的分子数目为0.5NA | |
| B. | 室温下,21.0g乙烯和丁烯的混合气体中所含的碳原子数目是NA | |
| C. | 室温下,2L0.05mol/L 的NH4NO3溶液中所含有的氮原子数目是0.2NA | |
| D. | 22.4L Cl2 与足量NaOH溶液反应时转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -(a+$\frac{b}{2}$+c)kJ/mol | B. | +(a+$\frac{b}{2}$+c)kJ/mol | C. | -(2a+b+2c)kJ/mol | D. | +(2a+b+2c)kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com