(2013?广州模拟)大型钢铁企业酸洗钢材时产生的废液主要成分为Fe
2+、H
+、Cl
-,可用下述方法处理该废液,回收盐酸,制备氧化铁涂料.
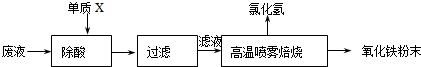
(1)单质X的化学式是
Fe
Fe
.
(2)氯化亚铁溶液经高温喷雾焙烧时转化为氯化氢气体和氧化铁粉末.有关的化学方程式为:
FeCl
2+2H
2O?Fe(OH)
2+2HCl,4Fe(OH)
2+O
2+2H
2O=4Fe(OH)
3,2Fe(OH)
3Fe
2O
3+3H
2O
FeCl
2+2H
2O?Fe(OH)
2+2HCl,4Fe(OH)
2+O
2+2H
2O=4Fe(OH)
3,2Fe(OH)
3Fe
2O
3+3H
2O
.
(3)某种铁红涂料的成分中,除含有Fe
2O
3外,还添加有CuO或FeO中的一种.请设计实验探究该铁红涂料中添加的物质.
①提出合理假设,假设1:添加了CuO.假设2:添加了FeO.
②基于假设
1
1
(填“1”或“2”),设计实验方案,进行实验.在答题卡上写出实验步骤、预期现象和结论.限选实验试剂:铁粉、3mol?L
-1H
2SO
4、0.01mol?L
-1酸性KMnO
4溶液、10%NaOH溶液、10%H
2O
2、KSCN溶液
| 操作步骤 |
预期现象和结论 |
| 步骤1.取少量样品于试管中, 加入足量的3mol?L-1H2SO4,充分振荡 加入足量的3mol?L-1H2SO4,充分振荡 |
样品全部溶解 样品全部溶解 |
步骤2.
取少许溶液于试管中,加入足量铁粉,充分振荡;再加入足量3mol?L-1H2SO4,充分振荡 取少许溶液于试管中,加入足量铁粉,充分振荡;再加入足量3mol?L-1H2SO4,充分振荡 |
试管中出现红色固体,说明试样中有CuO 试管中出现红色固体,说明试样中有CuO |
(4)用水吸收“高温喷雾焙烧”时产生的氯化氢气体可得到盐酸.请计算:用1000g水需吸收标准状况下多少升氯化氢气体可得到36.5%的浓盐酸?(写出计算过程,结果可用数学表达式表示,不必化简).
设所需的HCl体积为V,则溶质质量是:
g,溶液质量=溶质质量+溶剂质量=1000g+
g,所以
g=(1000g+
g)×36.5%,解得V=
L.
设所需的HCl体积为V,则溶质质量是:
g,溶液质量=溶质质量+溶剂质量=1000g+
g,所以
g=(1000g+
g)×36.5%,解得V=
L.
.




 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案