
分析 氯气与石灰乳反应生成氯化钙和次氯酸钙,漂白粉的有效成分为次氯酸钙,若将漂白粉长期放置在空气中会逐渐失效,是因与水、二氧化碳反应生成HClO,Fe能与酸发生反应,以此来解答.
解答 解:氯气与Ca(OH)2反应生成CaCl2、Ca(ClO)2和水,反应的方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,漂白粉的有效成分为次氯酸钙,溶于水(含CO2)后,发生反应生成碳酸钙和HClO,该反应为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,一旦液氯中混有水时,则钢瓶会很快被腐蚀,这是因为氯气与水反应生成HCl、HClO,Fe与酸反应使钢瓶会很快被腐蚀,
故答案为:次氯酸钙;Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;氯气与水反应生成HCl、HClO,Fe与酸反应.
点评 本题考查物质的性质,为高频考点,把握卤素元素的单质和化合物的性质为解答的关键,题目难度不大,注意氯气、次氯酸及其盐的性质和用途,学习中注意了解漂白粉的组成和性能.


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:选择题
| A. | 漂白粉久置于空气中会增加漂白效果 | |
| B. | 以海水为原料能制取Na、HCl、Mg、Br2等物质 | |
| C. | 蓝铜矿[Cu3(OH)2(CO3)2]也可表示为3CuO•2CO2•2H2O | |
| D. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向偏铝酸钠溶液中滴加过量盐酸:AlO2-+H++H2O=A1(OH)3↓ | |
| B. | 碳酸氢钠溶液与少量的石灰水:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| C. | 向三氯化铁溶液中加入过量铜屑:2Fe3++3Cu=2Fe+3Cu2+ | |
| D. | 用NaOH溶液吸收少量Cl2气体:OH-+Cl2=Cl-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氨水加水稀释后,溶液中c (NH3•H2O)/c (NH4+)的值减小,c (H+)增大 | |
| B. | 因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 | |
| C. | 相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次增强 | |
| D. | 加热蒸干氯化铝溶液并灼烧残留物至质量不变,所得固体为氧化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
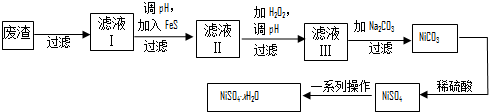
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的NaHSO3溶液中:c(Na+ )>c(HSO3-)>c(H2SO3)>c(SO32-) | |
| B. | 0.01mol•L-1 的NaHCO3 溶液中存在如下平衡:HCO3-?H++CO3 2-,加水稀释溶液中的HCO3-、H+、CO3 2-浓度减少 | |
| C. | 浓度均为0.1mol•L-1 的CH3COOH、CH3COOK混合溶液中,2c(H+)+c(CH3COOH)=2c(OH-)+c(CH3COO-) | |
| D. | 若Ka(HA)=3.6×10-4,Ka(HB)=1.75×10-5,则等物质的量浓度的NaA、KB溶液相比:c(Na+ )-c(A-)=c(K+ )-c(B-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
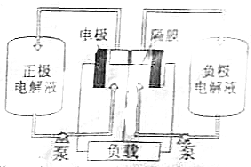 偏钒酸铵(NH4VO3)为白色或微黄色的晶体粉末,微溶于水和氨水,而难溶于冷水,在钒的湿法冶金中占重要地位.
偏钒酸铵(NH4VO3)为白色或微黄色的晶体粉末,微溶于水和氨水,而难溶于冷水,在钒的湿法冶金中占重要地位.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作设计 | 现象记录 | 结论解释 | |
| A | 将少量浓硝酸逐滴加入Cu 和稀硫酸的混合物中 | 产生红棕色气体 | 硝酸被还原为NO2 |
| B | 用坩埚钳夹住铝箔在酒精灯 上加热 | 铝箔熔化但并不滴落 | 熔点:Al2 O3>Al |
| C | 向某氯化亚铁溶液中加入 Na2O2粉末 | 出现红褐色沉淀 | 加入Na2O2粉末前,原氯化 亚铁溶液已经变质 |
| D | 向紫色石蕊试液中持续长时 间通人氯气 | 溶液先变红,最后变 为无色 | 氯气有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com