
| A. | 苯和乙烯都能使溴水褪色,且反应原理相同 | |
| B. | 乙炔和苯均为不饱和烃,都只能发生加成反应 | |
| C. | 分子式为C10H14 苯环上只有一个取代基的芳香烃,其可能的结构有3种 | |
| D. | 乙烯和氯乙烯都可以通过聚合反应得到高分子材料 |
分析 A.苯能使溴水褪色是因为发生萃取,乙烯和溴发生加成反应而使溴水褪色;
B.苯在一定条件下能和氢气发生加成反应;
C.分分子式为C10H14 苯环上只有一个取代基的芳香烃,为-C4H9,书写-C4H9的异构体,确定符合条件的同分异构体数目;
D.含有碳碳不饱和键的有机物能发生加聚反应.
解答 解:A.苯能使溴水褪色是因为发生萃取,乙烯和溴发生加成反应而使溴水褪色,前者属于物理变化、后者属于化学变化,所以其原理不同,故A错误;
B.苯在一定条件下能和氢气发生加成反应,所以苯在一定条件下能发生加成反应、取代反应,故B错误;
C.分分子式为C10H14 苯环上只有一个取代基的芳香烃,为-C4H9,-C4H9的异构体有:-CH2CH2CH2CH3、-CH(CH3)CH2CH3、-CH2CH(CH3)2、-C(CH3)3,故符合条件的结构有4种,故C错误;
D.含有碳碳不饱和键的有机物能发生加聚反应,乙烯和氯乙烯中都含有碳碳双键,所以都能发生加聚反应,故D正确;
故选D.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查烯烃、苯的性质,注意萃取和加成区别,题目难度不大.


科目:高中化学 来源: 题型:解答题
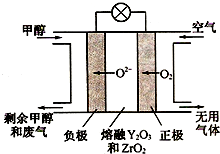 铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广泛.铁还有很多的化合物及其化学反应,如铁与水的反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H
铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广泛.铁还有很多的化合物及其化学反应,如铁与水的反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁是目前人类使用量最大的金属,它能形成多种化合物.
铁是目前人类使用量最大的金属,它能形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
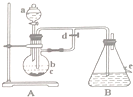 如图所示装置,可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化.实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.填写下列空白:
如图所示装置,可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化.实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.填写下列空白:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com