
【题目】控制适合的条件,将反应2Fe3++2I-![]() 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
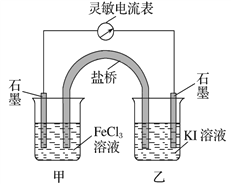
A. 反应时,电子从乙中石墨电极沿导线流向甲中石墨电极
B. 反应时,甲中石墨电极发生还原反应
C. 电流表读数为零时,反应达到化学平衡状态
D. 电流表读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
科目:高中化学 来源: 题型:
【题目】有A、B、C三种元素,已知A元素原子的K层和M层电子数相同;B元素原子的L层比K层电子数多5个;C元素的+3价阳离子和氖原子具有相同的电子数。
(1)写出A的元素符号___________________;元素C的一种原子(中子数为14)的原子符号_______________;
(2)B的阴离子结构示意图________;A、B组成的化合物的化学式__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2 mol/L H2(g)、0.5 mol/L I2(g)及0.3 mol/L HI(g),则下列说法中正确的是
2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2 mol/L H2(g)、0.5 mol/L I2(g)及0.3 mol/L HI(g),则下列说法中正确的是
A. 反应向逆反应方向进行
B. 反应向某方向进行一段时间后c(H2)<0.2 mol/L
C. 若升温后,K减小,说明该反应是吸热反应
D. 反应向某方向进行一段时间后K<57.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.84 gcm﹣3、溶质的质量分数为98 %的硫酸,配制250 mL物质的量浓度为0.46 molL﹣1的硫酸。
(1)98 %的浓硫酸的物质的量浓度为_____。
(2)现有下列几种规格的量筒,应选用_____(填序号)。
①5 mL量筒 ②10 mL量筒 ③50 mL量筒 ④100 mL量筒
(3)实验需要以下步骤:①定容②量取③摇匀④洗涤⑤转移⑥冷却⑦计算⑧装瓶⑨稀释进行顺序为_____。
A. ⑦②④⑨⑥③⑤①⑧ B.⑦②⑥⑨⑤④③①⑧
C.⑦②⑨⑥⑤④①③⑧ D. ⑦②⑨⑥④⑤③①⑧
(4)下列操作使所配溶液的物质的量浓度偏高的是______。
A.往容量瓶中转移溶液时有少量液体溅出
B.未洗涤稀释浓H2SO4的小烧杯
C.定容时俯视刻度线
D.洗净容量瓶未干燥即用来配制溶液
E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质,都能与Na反应放出H2,其产生H2的速率排列顺序正确的是( )
①C2H5OH②CH3COOH(aq)③H2O
A.①>②>③B.②>①>③C.③>①>②D.②>③>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),电解中发现Ag电极有气体产生。请回答下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),电解中发现Ag电极有气体产生。请回答下列问题。

甲池 乙池
(1)B是铅蓄电池的________极,放电过程中A电极反应式:_______________________。
(2)电解后甲池中电解液的pH________(填“减小”“增大”或“不变”)。若甲池中产生气体11.2L(标准状况下),此时乙池中理论上Zn电极最多产生固体________ g。
(3)乙池中 C(碳)电极是_________极。C电极的电极反应式是___________________,反应一段时间后,向乙池中加入一定量的___________(填化学式)固体,能使CuSO4溶液恢复到原浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
Ⅰ、稀Na2S溶液有一种臭鸡蛋气味,加入AlCl3溶液后,臭鸡蛋气味加剧,用离子方程式表示气味加剧过程所发生的离子反应方程式_________________________________。
Ⅱ、常温下,向20mL 0.2molL﹣1H2A溶液中滴加0.2molL﹣1NaOH溶液.有关微粒的物质的量变化如下图(Ⅰ代表H2A,Ⅱ代表HA﹣,Ⅲ代表A2﹣)

(1)H2A在水中的电离方程式为_________________________。
(2)当V(NaOH)=20 mL时,写出H2A与NaOH反应的离子方程式_________________。此时溶液中所有离子浓度大小关系:__________________。
(3)向NaHA溶液中加水,HA﹣的电离度_________、溶液的pH________。(填增大、减小、不变、无法确定)。
(4)V(NaOH)=30 mL时,溶液中存在如下关系:2c(H+)﹣2c(OH﹣)________2c(A2﹣)﹣3c(H2A)﹣c(HA﹣)(填“<”“>”或“=”)。
(5)某校研究性学习小组开展了题为“H2A是强酸还是弱酸的实验研究”的探究活动。该校研究性学习小组设计了如下方案:你认为下述方案可行的是_______(填编号);
A.测量浓度为0.05 mol/L H2A溶液的pH,若pH大于1,则可证明H2A为弱电解质
B.可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C.比较中和等体积、等物质的量浓度的硫酸和H2A溶液所需氢氧化钠的量多少,可证明H2A是强酸还是弱酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用蒸馏水稀释1mol/L氨水至0.01mol/L,随溶液的稀释,下列各项中始终保持增大趋势的是
A. c(OH-)/ c(NH3·H2O) B. c(NH![]() )/ c(OH-)
)/ c(OH-)
C. c(NH3·H2O)/ c(NH![]() ) D. c(OH-)
) D. c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.反应C(s)+CO2(g)=2CO(g);△H>0,在任何条件下均不能自发进行
B.铅蓄电池在放电过程中,溶液的PH值增加
C.常温下,在0.1mol/L氨水中,加入少量NH4Cl晶体,溶液的pH减小
D.温度一定时,水的离子积常数Kw不随外加酸(碱)浓度的改变而改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com