
| ⅠA | Ⅷ | ||||||
| ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| ② | ③ | ④ | ⑧ | ||||
| ⑤ | ⑥ | ⑦ | ⑨ | ||||
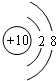
 .
. 分析 根据①~⑨九种元素在周期表中的位置知,它们分别是H、C、N、O、Na、P、S、Ne、Cl元素,
(1)稀有气体原子最外层电子达到稳定结构,其性质最不活泼,所以这几种元素中最不活泼的是Ne元素,其原子核内有10个质子、核外有2个电子层且最外层有8个电子;
(2)元素的非金属性越强,其氢化物的稳定性越强;
(3)电子层结构相同的离子,离子半径随着原子序数增大而减小;
(4)⑤与⑦分别是活泼金属元素和活泼非金属元素,二者通过得失电子形成离子化合物硫化钠.
解答 解:根据①~⑨九种元素在周期表中的位置知,它们分别是H、C、N、O、Na、P、S、Ne、Cl元素,
(1)稀有气体原子最外层电子达到稳定结构,其性质最不活泼,所以这几种元素中最不活泼的是Ne元素,其原子核内有10个质子、核外有2个电子层且最外层有8个电子,其原子结构示意图为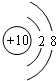 ,故答案为:
,故答案为: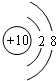 ;
;
(2)元素的非金属性越强,其氢化物的稳定性越强,⑥④⑦的非金属性强弱顺序是O>S>P,所以氢化物的稳定性最强的是H2O,故答案为:H2O;
(3)电子层结构相同的离子,离子半径随着原子序数增大而减小,这三种离子半径大小顺序是,故答案为:N3->O2->Na+,故答案为:N3->O2->Na+;
(4)⑤与⑦分别是活泼金属元素和活泼非金属元素,二者通过得失电子形成离子化合物硫化钠,其形成过程为 ,故答案为:
,故答案为: .
.
点评 本题考查元素周期表的综合应用,涉及元素推断、元素周期律、化学用语等知识点,为基础题,明确元素周期表结构、元素周期律及物质结构是解本题关键,知道氢化物稳定性强弱判断方法,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
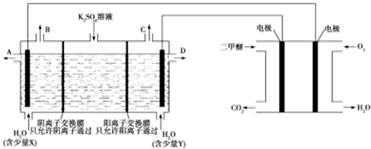
| A. | Y为KOH | |
| B. | A口导出的物质为H2SO4 | |
| C. | 二甲醚燃料电池的负极反应式为CH3OCH3+3H2O-12e-═2CO2+12H+ | |
| D. | 若燃料电池通入CH3OCH3(g)的速率为0.1mol/min,2min时,理论上C口收集到气体的体积为26.88L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶于酸的物质 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |
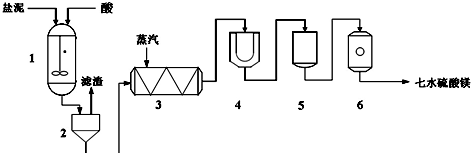
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
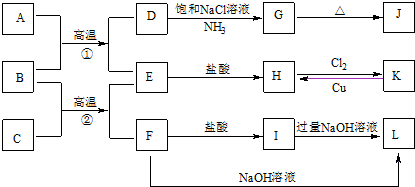
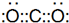 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH小于7的雨水称为酸雨 | |
| B. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| C. | O3可用于游泳池的杀菌消毒 | |
| D. | 黄铜是纯铜,青铜是合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
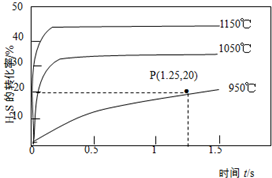 硫化氢分解制取氢气和硫磺的原理为:2H2S(g)?S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )
硫化氢分解制取氢气和硫磺的原理为:2H2S(g)?S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )| A. | 图中P点:v(正)>v(逆) | |
| B. | 正反应为放热反应 | |
| C. | 950℃时,0~1.25s生成H2的平均反应速率为:0.008mol•L-1•s-1 | |
| D. | 950℃时,该反应的平衡常数的值小于3.125×10-4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com