
【题目】一种肼燃料电池的结构如图所示,下列说法正确的是( )
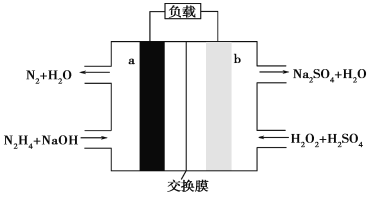
A. a极是正极,电极反应式为N2H4-4e-+4OH-=N2↑+4H2O
B. 电路中每转移NA个电子,就有1mol Na+穿过膜向正极移动
C. b极的电极反应式为H2O2+2e-=2OH-
D. 用该电池作电源电解饱和食盐水,当得到0.1mol Cl2时,至少要消耗0.1mol N2H4
【答案】B
【解析】
根据图知,a电极上N元素化合价由-2价变为0价,所以a是负极,则b是正极,负极反应式为N2H4-4e-+4OH-=N2↑+4H2O,正极上电极反应式为H2O2+2e-+2H+=2H2O。
A.a电极上N元素化合价由-2价变为0价,所以a是负极,负极反应式为N2H4-4e-+4OH-=N2↑+4H2O,A错误;
B.电路中每转移6.02×1023个电子,根据电荷守恒知,有1molNa+穿过膜向正极移动,B正确;
C.酸性溶液中不能得到OH-,b电极反应式为H2O2+2e-+2H+=2H2O,C错误;
D.阳极上生成标况下2.24L氯气,其物质的量是0.1mol,根据转移电子守恒得肼的物质的量=![]() =0.05mol,D错误;
=0.05mol,D错误;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 、
、![]() 、
、![]() 为原子序数依次增大的短周期元素,
为原子序数依次增大的短周期元素,![]() 为地壳中含量最高的过渡金属元素,
为地壳中含量最高的过渡金属元素,![]() 与
与![]() 同主族,
同主族,![]() 与
与![]() 同周期,且
同周期,且![]() 与
与![]() 的原子序数之和为20。甲、乙分别为元素E、A的单质, 丙、丁为A、E分别与B形成的二元化合物,它们转化关系如图所示。下列说法不正确的是( )
的原子序数之和为20。甲、乙分别为元素E、A的单质, 丙、丁为A、E分别与B形成的二元化合物,它们转化关系如图所示。下列说法不正确的是( )
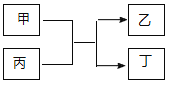
A.![]() 、
、![]() 形成的一种化合物具有漂白性
形成的一种化合物具有漂白性
B.![]() 、
、![]() 形成的离子化合物可能含有非极性键
形成的离子化合物可能含有非极性键
C.![]() 的单质能与丙反应置换出
的单质能与丙反应置换出![]() 的单质
的单质
D.丁为黑色固体,且1mol甲与足量丙反应转移电子3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.1 mol Na2O2固体中含离子的总数为4NA
B.Na2O2与H2O反应生成1.12 L O2(标准状况),反应中转移的电子数为0.2NA
C.1 mol氧气与钠反应,转移的电子数为一定为4NA
D.将1 mol甲醇(CH4O)完全燃烧生成的CO2和水蒸气通过足量的Na2O2固体,充分反应后固体增重32 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨对人类的生产生活具有重要影响。
(1)氨的制备与利用。
① 工业合成氨的化学方程式是____________。
②氨催化氧化生成一氧化氮反应的化学方程式是___________。
(2)氨的定量检测。水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图如下:
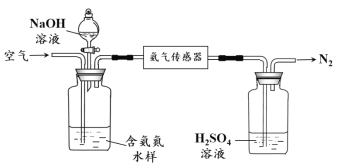
① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用:_______________。
② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol,则水样中氨氮(以氨气计)含量为________mg·L-1。
(3)氨的转化与去除。 微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。
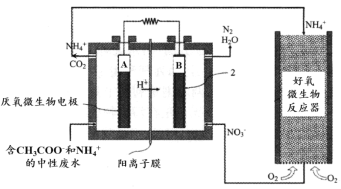
已知A、B两极生成CO2和N2的物质的量之比为5 : 2,写出A极的电极反应式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究性学习的本质在于,让学生亲历知识产生与形成的过程。我校某化学研究性学习小组欲以CO2为主要原料,采用下图所示装置模拟“侯氏制碱法”制取NaHCO3,并对CO2与NaOH的反应进行探究.
【资料获悉】“侯氏制碱法”原理:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,然后再将NaHCO3灼烧制成Na2CO3.
【实验设计】如图1所示

【实验探究】
(1)装置乙的作用是 .
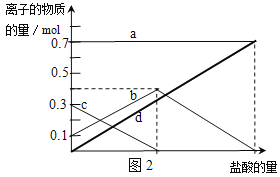
(2)若在NaHCO3灼烧中时间较短,NaHCO3将分解不完全.取经短暂加热的NaHCO3样品29.6g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中有关离子的物质的量的变化如图2所示.则曲线b对应的溶液中的离子是 (填离子符号);该样品中Na2CO3和NaHCO3的物质的量之比是 。
(3)若将装置甲产生的纯净的CO21.68L(标准状况下)缓慢地全部通入到100mL NaOH溶液中,充分反应后,将溶液低温蒸干,得到不含结晶水的固体W,其质量为7.4g,则W的成分为 (填化学式),原NaOH溶液的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素,A元素的一种核素无中子,F元素的最外层电子数是次外层电子数的0.75倍,B元素的的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。请回答:
(1)A、D、F形成化合物的电子式_____________。
(2)工业上在高温的条件下,可以用A2C和BC反应制取单质A2。在2L密闭容器中分别充入1 mol A2C和1 mol BC, —定条件下,2 min达平衡时生成0.4mol A2,则用BC表示的反应速率为________。下列关于该反应的说法中正确的是__________________。
A.增加BC2的浓度始终不能提高正反应速率
B.若混合气体的密度不再发生变化,则反应达到最大限度
C.A2是一种高效优质新能源
D.若生成1 molA2,转移2mol电子
(3)用A元素的单质与C元素的单质及由A、C、D三种元素组成的化合物的溶液构成燃料电池,写出该电池的电极反应式:负极____________,正极_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验一:
如图所示为实验室制取蒸馏水的装置示意图。

根据图示回答下列问题:
图中两处明显错误是:
①________; ②________。
(2)A仪器的名称是________, B仪器的名称是________。
(3)实验时,A中除加入少量自来水外,还需要加入少量的________,其作用是________。
(4)实验二:
碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4,该小组先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和KI溶液,转移到分液漏斗中,再加入一定量的苯,振荡。分液漏斗使用前应先________,振荡后上层液体为________(填有机层、水层)。
(5)萃取碘水中的I2单质时要用到萃取剂,下列关于所加萃取剂的说法正确的是______
A.不与碘反应
B.碘在其中的溶解度远大于在水中的溶解度
C.该萃取剂与水不互溶且密度比水大
D.可以选用CCl4、酒精做萃取剂
(6)某学生在一次分液操作中发现上下层溶液都是无色液体,无法知道分液漏斗中的液体哪一层是有机层,哪一层是水层,请你用简单的方法帮他鉴别出来,写出有关步骤及判断方法________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙实验小组设计如下实验装置分别制备SnCl4和漂白粉。
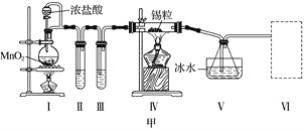
(1)已知:a.金属锡熔点231 ℃,化学活泼性与铁相似;
b.干燥的氯气与熔融金属锡反应生成SnCl4,SnCl4的沸点114 ℃;
c.SnCl2、SnCl4均易水解,易溶于有机溶剂,且Sn2+易被氧化。根据图甲装置回答:
①试管Ⅱ中的试剂是____________________,Ⅲ中的试剂是________________________。
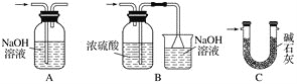
②Ⅵ处装置最好选用________(填字母)。
③Ⅰ处装置中反应的离子方程式是____________________________________________。
④实验结束后,欲回收利用装置Ⅰ中未反应完的MnO2,需要的玻璃仪器有______________。
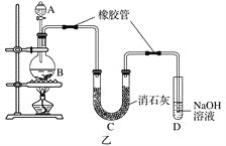
(2)已知:①Cl2与潮湿的消石灰反应是放热反应;②温度较高时Cl2与潮湿Ca(OH)2的反应为6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。
根据图乙装置回答:此实验所得Ca(ClO)2产率较低的理由是
①________________________________________________________________________;
②________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业上用112 L(标准状况)氯气与足量石灰乳反应,制得的漂白粉中有效成分Ca(ClO)2的最大含量为___________mol。
(2)向一定量石灰乳中缓慢通入氯气,随着反应的进行,温度升高,开始产生Ca(ClO3)2。体系中ClO-和ClO3-的物质的量(n)与反应时间(t)的关系曲线如图1所示(不考虑氯气和水的反应)。
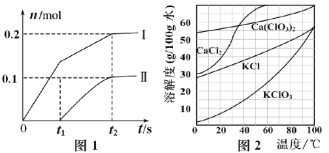
①t2时刻后,溶液中ClO-和ClO3-的物质的量之比为_____________。
②该反应过程中消耗Ca(OH)2的质量为_____________。
(3)向Ca(ClO3)2浓溶液中加入稍过量的KCl固体可转化为KClO3,如图2,从该溶液中分离出KClO3固体的实验方法是________________(不要求填具体操作步骤)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com