
【题目】下列有关说法正确的是( )
A.反应2NO2N2O4在室温下可自发进行,则该反应的△H<0
B.工业上电解熔融态氯化铝冶炼单质铝
C.CH3COOH溶液加水稀释后,溶液中![]() 的值增大
的值增大
D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小
科目:高中化学 来源: 题型:
【题目】如图为不同温度下水的电离平衡曲线,已知pOH=lgc(OH),下列说法正确的是
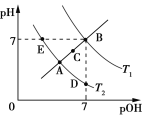
A. T1和T2的关系是:T1>T2
B. KW的关系是:B>C>A=D=E
C. A点到D点:加入少量酸可实现
D. T2时:pH=2的硫酸与pH=12的NaOH溶液等体积混合,溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向一个容积为2L的密闭容器内(预先加入催化剂)通入2molNH3,经过一段时间后,测得容器内的压强为起始时的1.2倍.则NH3的转化率为( )
A. 25%B. 80%C. 10%D. 20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁单质及化合物与我们的生产、生活紧密相关。
(1)Fe3+的基态核外价电子排布式为______,应用原子结构比较Fe与同周期的Mn第三电离能(I3)的大小:I3(Mn)_______I3(Fe)(填>、<、=)。理由是_______。
(2)Fe、Fe2+、Fe3+可以与CO、SCN-、CN-、H2NCONH2(尿素)等多种配体形成很多的配合物。
①配合物Fe(CO)5的熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如图所示:
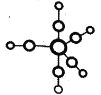
下列关于Fe(CO)5说法不正确的是________。
A.Fe(CO)5是分子晶体
B.Fe(CO)5中Fe原子的配体与C22-互为等电子体
C.Fe(CO)5中σ键与π键之比为1:1
D.Fe(CO)5=Fe+5CO反应中没有新化学键生成
②CN-的电子式为__________。
③H2NCONH2(尿素)中N、C原子的杂化方式分别为__________、__________,
组成尿素的4种元素的第一电离能由大到小的顺序为__________,1 mol H2NCONH2(尿素)分子中含有σ键的数目为__________。
(3)NaCl和MgO都属于离子化合物,NaCl的熔点为801.3C,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是________。
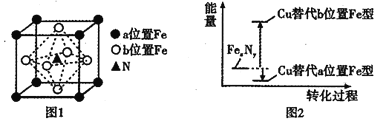
(4)FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置的Fe或者b位置的Fe,形成Cu替代型产物Fe(x-n)CunNy,FexNy转化为两种Cu的替代型产物的能量变化如图2所示,其中相对不稳定的Cu替代型产物的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.反应2Mg+CO2![]() 2MgO+C ΔH<0从熵变角度看,可自发进行
2MgO+C ΔH<0从熵变角度看,可自发进行
B.在密闭容器发生可逆反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小
N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小
C.已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生
D.根据HClO的Ka=3.0×10-8,H2CO3的Ka1=4.3×10-7, Ka2=5.6×10-11,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者小于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.4CuO(s)=2Cu2O(s)+O2(g)在室温下不能自发进行,说明该反应△H>0
B.向稀醋酸中加入醋酸钠固体,溶液pH升高的主要原因是醋酸钠水解呈碱性
C.室温下K(HCN)<K(CH3COOH),说明CH3COOH的电离度一定比HCN大
D.H2S(g)+FeO(s)![]() FeS(s)+H2O(g),其他条件不变时增大压强,反应速率V正(H2S)和H2S的平衡转化率均增大
FeS(s)+H2O(g),其他条件不变时增大压强,反应速率V正(H2S)和H2S的平衡转化率均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示装置中,观察到电流计指针偏转,M棒变细,N棒变粗,其中P为电解质溶液。由此判断M、N、P所代表的物质不可能是( )
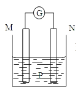
M | N | P | |
A | Zn | Cu | 稀硫酸 |
B | Fe | Cu | 硫酸铜溶液 |
C | Zn | Ag | 硝酸银溶液 |
D | Zn | Fe | 硝酸铜溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示在20ml0.1molL-1CH3COOH溶液中逐滴加入0.1mo1L-1的NaOH溶液的pH变化曲线。下列说法正确的是( )
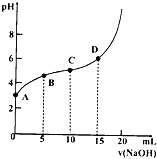
A.A点溶液存在的关系:c(H+)=c(OH-)+Ka(CH3COOH)-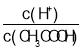
B.C点溶液中各微粒浓度的大小关系为:c(CH3COOH)>c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.在C点溶液中加少量的酸或碱溶液,pH变化不大
D.D点为该反应的滴定终点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2A的pKa1=1.85,pKa2=7.19。常温下,用0.1mol·L—1NaOH溶液滴定20mL0.l mol·L—1H2A溶液的滴定曲线如右图所示(曲线上的数字为pH)。下列说法正确的是
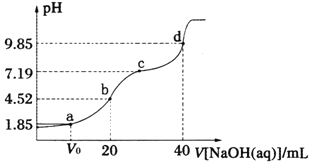
A. a点所得溶液中c(H2A)+c(A2—)+c(HA—)=0.1 mol·L—1
B. b点所得溶液中:c(H2A)+2c(H+)=c(A2—)+2c(OH—)
C. 对应溶液的电导率:a<b<c<d
D. 对应溶液水的电离程度:a>b>c>d
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com