
| A. | C2H2、C2H4 | B. | C2H6、C2H8 | C. | C2H4、C4H8 | D. | CH4、C3H6 |
分析 设烃的平均组成为CxHy,根据体积之比等于物质的量之比,利用原子守恒可知平均分子式为C2H5,结合选项,计算C、H原子平均数判断.
解答 解:20mL该混合气体在足量的O2中完全燃烧生成了50mLH2O(g)和40mL CO2(在同温同压下测定),
设烃的平均组成为CxHy,则:
根据C原子守恒有:20x=40,则x=2,
根据H原子守恒有:20y=50×2,则y=5,
即平均分子组成为C2H5,
A.C2H2和C2H4的H原子平均数介于2~4之间,不可能为5,故A错误;
B.C2H6、C2H8的H原子平均数介于6~8之间,不可能为5,故B错误;
C.C2H4、C4H8,C原子平均数介于2≈4,不可能为2,故C错误;
D.CH4、C3H6按照1:1混合时,C原子平均数为:$\frac{1+3}{2}$,H原子平均数为:$\frac{4+6}{2}$=5,平均分子组成为C2H5,满足条件,故D正确;
故选D.
点评 本题考查了有机物分子式确定的计算、混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握平均值法在化学计算中的应用方法,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:解答题
| 卤素 | 氰 | 硫氰 | ① | |
| “单质” | X2 | (CN)2 | (SCN)2 | (OCN)2 |
| 酸 | HX | HCN | ② | HOCN |
| 盐 | KX | KCN | KSCN | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核内有8个中子的碳原子:${\;}_{6}^{8}$C | B. | 18O2-的结构示意图: | ||
| C. | 羟基的电子式: | D. | 淀粉和纤维素的结构简式:CH2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 皮肤上不慎沾到少量浓硫酸,应先用干抹布擦拭、再用大量水冲洗 | |
| B. | 检验HCl气体中是否混有Cl2,可将气体通入硝酸银溶液 | |
| C. | 验证某气体中含CO2、SO2,可依次通入品红溶液、饱和NaHCO3溶液、澄清石灰水 | |
| D. | 检验Fe2(SO4)3溶液中是否含有Fe2+,可用KMnO4酸性溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡含离子键的物质中,一定含有金属元素 | |
| B. | 非金属元素的原子间不可能形成离子化合物 | |
| C. | 离子化合物中只含有离子键 | |
| D. | 共价化合物中只含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{94}^{238}$Pu、${\;}_{94}^{239}$Pu和${\;}_{94}^{240}$Pu是钚的三种同素异形体 | |
| B. | ${\;}_{94}^{238}$Pu中有94个中子 | |
| C. | ${\;}_{94}^{239}$Pu的中子数与质子数之差为51 | |
| D. | 一个${\;}_{94}^{240}$Pu的质量为240 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .有机物X的键线式为
.有机物X的键线式为  ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | X的化学式为C8H8 | |
| B. | 有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为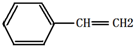 | |
| C. | X能使酸性高锰酸钾溶液褪色 | |
| D. | X与足量的H2在一定条件下反应,可生成环状的饱和烃Z,Z的一氯代物有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 指示剂 | 酚酞 | 甲基酸 |
| 变色范围(pH) | 8.2-10.0 | 3.1-4.4 |
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀时pH | 1.1 | 5.9 | 8.4 |
| 沉淀完全时pH | 3.? | 9.? | 10.2 |
| 溶度积常数 | 4×10-34 | 8×10-16 | 2×10-13 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com