

 (写结构简式)可以合成二肽(如图2)
(写结构简式)可以合成二肽(如图2) 分析 有机物A是构成营养素的基础物质,属于有机物,蓝色球连接4个原子,为C原子,白色球连接1个原子,为H原子,蓝色球连接3个原子,为N原子,红色球连接2个原子,为O原子,可知A的结构简式为NH2CH2COOH,含有氨基、羧基,具有两性,可以发生酯化反应,不能发生消去反应,氨基酸分子中羧基羰基-OH、氨基提供H,脱去水形成肽键.
解答 解:(1)有机物A是构成营养素的基础物质,属于有机物,蓝色球连接4个原子,为C原子,白色球连接1个原子,为H原子,蓝色球连接3个原子,为N原子,红色球连接2个原子,为O原子,可知A的结构简式为NH2CH2COOH,分子式为:C2H5O2N,官能团为:羧基、氨基,故答案为:C2H5O2N;羧基、氨基;
(2)A名称为甘氨酸,含有氨基、羧基,具有两性,可以发生酯化反应,不能发生消去反应,故答案为:ad;
(3)氨基酸分子中羧基羰基-OH、氨基提供H,脱去水形成肽键,由二肽 的结构,是由A与
的结构,是由A与 形成的二肽,
形成的二肽,
故答案为: .
.
点评 本题考查有机物的结构与性质,注意根据原子连接其它原子数目判断有机物的结构,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
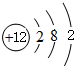 ;画出BC2的电子式
;画出BC2的电子式 ,结构式O=C=O,其晶体类型为分子晶体
,结构式O=C=O,其晶体类型为分子晶体 ,其晶体类型为离子晶体.
,其晶体类型为离子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在273K(即0℃)时,向如图所示的真空密闭容器A中充入0.5g H2时,测得容器内的压强为1.01×105Pa.由此可以判断A容器的体积约为5.6L.若向A中充入的是O2,压强也是1.01×105pa,则充入的O2质量是8g,若向A容器中充入的是C0气体,使容器内压强达到3.03×105Pa.则充入C0气体的质量是21g.
在273K(即0℃)时,向如图所示的真空密闭容器A中充入0.5g H2时,测得容器内的压强为1.01×105Pa.由此可以判断A容器的体积约为5.6L.若向A中充入的是O2,压强也是1.01×105pa,则充入的O2质量是8g,若向A容器中充入的是C0气体,使容器内压强达到3.03×105Pa.则充入C0气体的质量是21g.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
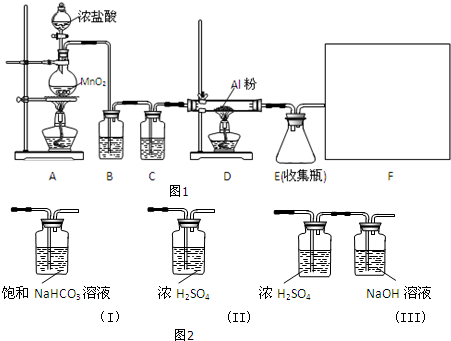
 | 1 | 2 | 3 | 4 |
| V( 样品 ) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(初读数) | 0.00 | 0.50 | 0.70 | 1.00 |
| V(NaOH)(终读数) | 22.60 | 22.25 | 22.05 | 23.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )| A. | X为直流电源的负极,Y为直流电源的正极 | |
| B. | 阳极区pH增大 | |
| C. | 阴极区的电极反应为:2H++2e=H2↑ | |
| D. | 该过程中可以循环利用的物质是Na2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
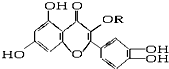 天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )
天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )| A. | 可与溴水反应,且1 mol该物质与足量溴水反应消耗6 mol Br2 | |
| B. | 可与NaOH溶液反应,1 mol该物质可与5 mol NaOH反应 | |
| C. | 一定条件下1 mol该物质可与H2加成,耗H2最大量为6 mol | |
| D. | 维生素P能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15种 | B. | 28种 | C. | 32种 | D. | 40种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13 | B. | 13 | C. | 11 | D. | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com