
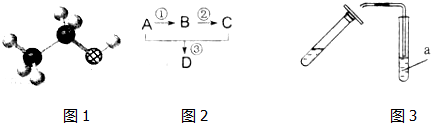
分析 根据A的球棍模型及各物质转化关系,A为CH3CH2OH,A氧化得B为CH3CHO,B氧化得C为CH3COOH,A与C发生酯化反应得D为CH3COOCH2CH3,实验室制用饱和碳酸钠溶液收集CH3COOCH2CH3,生成的CH3COOCH2CH3浮于水溶液上层,用分液的方法分离,据此答题.
解答 解:根据A的球棍模型及各物质转化关系,A为CH3CH2OH,A氧化得B为CH3CHO,B氧化得C为CH3COOH,A与C发生酯化反应得D为CH3COOCH2CH3,实验室制用饱和碳酸钠溶液收集CH3COOCH2CH3,生成的CH3COOCH2CH3浮于水溶液上层,用分液的方法分离,
(1)根据上面的分析可知,有机物A的结构简式是CH3CH2OH,其含有的官能团名称是羟基,
故答案为:CH3CH2OH;羟基;
(2)反应③的化学方程式是CH3CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,其中反应①的类型是氧化反应,
故答案为:CH3CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O;氧化反应;
(3)实验室制备物质CH3COOCH2CH3时,试管a中实验前盛放的物质是Na2CO3,实验后出现分层现象,用分液的方法分离混合溶液,所以要用到分液漏斗,
故答案为:Na2CO3;分液漏斗.
点评 本题主要考查了各物质的转化及实验室制备乙酸乙酯的方法,难度不大,答题时注意基础知识的灵活运用.


科目:高中化学 来源: 题型:解答题
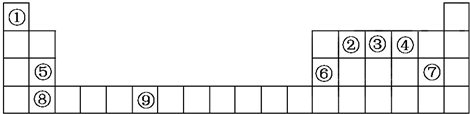
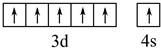
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期,E位于第四周期.A位于周期表中的s区,其原子中电子层数和未成对电子数相同;B的基态原子中的核外电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外电子总数是最内层电子总数的4倍.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期,E位于第四周期.A位于周期表中的s区,其原子中电子层数和未成对电子数相同;B的基态原子中的核外电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外电子总数是最内层电子总数的4倍.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
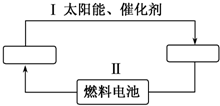 氢能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用.请在如图中的两个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在).
氢能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用.请在如图中的两个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ; COHC-CHO
; COHC-CHO +2nH2O,
+2nH2O,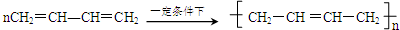
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

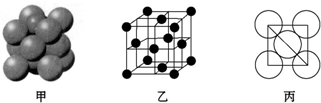
| A. | 甲用于浓盐酸和漂粉精制取并收集干燥的Cl2 | |
| B. | 乙用于测定盐酸的浓度 | |
| C. | 丙用于证明浓硫酸具有脱水性和强氧化性 | |
| D. | 丁用于制取金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的氯化铵溶液,用蒸馏水稀释10倍后,溶液的pH=5 | |
| B. | pH=3的盐酸与pH=3的CH3COOH溶液相比,c(Cl-)>C(CH3COO-) | |
| C. | pH=2的一元酸HA溶液与pH=12的NaOH溶液以体积比1:1混合后,c(Na+)≤c(A-) | |
| D. | pH相同的NaOH、NaClO两种溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com