
����Ŀ��ʵ���ҿ���KMnO4��Ũ���ᷴӦ��ȡ��������仯�ɱ���Ϊ��2KMnO4��16HCl(Ũ) ===2KCl��2MnCl2��5Cl2����8H2O��
��1���뽫������ѧ����ʽ��дΪ���ӷ���ʽ________________��
��2��Ũ�����ڷ�Ӧ����ʾ������������________________(��д���)��
��ֻ�л�ԭ���ڻ�ԭ�Ժ����� ��ֻ���������������Ժ�����
��3���˷�Ӧ������������________���ѧʽ��������0.5 mol Cl2����ת�Ƶĵ��ӵ����ʵ���Ϊ______mol��
��4����˫���ŷ���ʾ�÷�Ӧ�ĵ���ת�Ƶķ������Ŀ_______��
2KMnO4��16HCl(Ũ) ===2KCl��2MnCl2��5Cl2����8H2O
���𰸡�2MnO4����16H����10Cl��===2Mn2+��5Cl2����8H2O �� Cl2 1 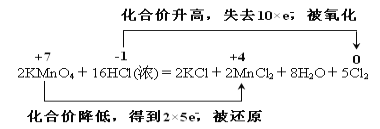
��������
��1�����ݻ�ѧ����ʽ��д��Ӧ�����ӷ���ʽ��
��2�����ݷ�Ӧ����Ԫ�ػ��ϼ������Լ����Ȼ������ɷ���Ũ��������ã�
��3����ԭ����ʧȥ���ӵ�Ԫ���γɵ��������������������Ԫ�صĻ��ϼ۱仯����ת�Ƶ��ӵ����ʵ�����
��4��������Ԫ�غ���Ԫ�صĻ��ϼ۱仯��ϵ��ӵ�ʧ�غ���
��1����Ӧ�е��κ�������ܣ�������ӣ����ʺ�ˮ���ܲ���˷�Ӧ2KMnO4��16HCl(Ũ)��2KCl��2MnCl2��5Cl2����8H2O�����ӷ���ʽΪ2MnO4����16H����10Cl����2Mn2+��5Cl2����8H2O��
��2����Ӧ����Ԫ�ػ��ϼ����ߣ�ʧȥ���ӱ�����������������Ӧ��Ũ�����ڷ�Ӧ����ʾ�����������ǻ�ԭ�ԣ�������Ȼ������ɣ���Ũ���ỹ�������ԣ���ѡ�ڣ�
��3���˷�Ӧ�����ᱻ������������������������Cl2����Ӧ����Ԫ�ػ��ϼ۴�-1�۱�Ϊ0�ۣ�ʧȥ1�����ӣ������0.5 mol Cl2ת�Ƶĵ��ӵ����ʵ���Ϊ0.5mol��2��1mol��
��4����Ӧ��MnԪ�ػ��ϼ۴�+7�۽��͵�+2�۵õ�5�����ӣ���Ԫ�ػ��ϼ۴�-1�۱�Ϊ0�ۣ�ʧȥ1�����ӣ�����˫���ŷ���ʾ�÷�Ӧ�ĵ���ת�Ƶķ������ĿΪ��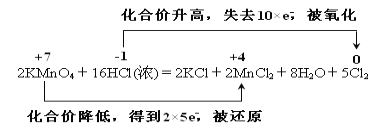 ��
��


 100�ִ�����ĩ���ϵ�д�
100�ִ�����ĩ���ϵ�д� ��У���˿��ֿ���ϵ�д�
��У���˿��ֿ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�ҷ��ֶ�ұ�����е�⾫���ᴿ�ɽ��ߴ����Ʊ��ɱ�����ص���װ����ͼ��ʾ����Cu-Si�Ͻ�����Դ����950����������Һ���ν��е�⾫�����й�˵������ȷ����
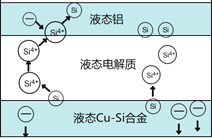
A. �ڸ�Һ��������Cu������Si��������Si4+������Cu2+����ԭ
B. ������Һ̬Cu-Si�Ͻ���������Һ̬������
C. ����Һ���ε������������ⷴӦ�������߹����Ч��
D. ����ǿ�Ȳ�ͬ����Ӱ����ᴿ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������������Ҵ����������( )
A.����B.̼��������Һ
C.��ˮD.��ɫʯ����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����30 mL 0.5 mol��L��1 NaOH��Һ��ˮϡ�͵�500 mL������ϡ�ͺ����Һ��������ȷ����(����)
A. Ũ��Ϊ0.03 mol��L��1 B. ����ȡ��10 mL��Һ����Ũ��Ϊ0.03 mol��L��1
C. ��NaOH 0.6 g D. ����ȡ��10 mL��Һ����NaOH 0.015 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ճ������е��������������ʱ仯�����л�ѧ��Ӧ���������ǣ� ��
A.ըҩ��ըB.ţ�̱���C.��������D.�ܶ��γ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ǵ���������������ҪԪ��֮һ��������������Ҫ�ɷ��ǹ����ε��ǣ�������
A.�մ�
B.���ʯ
C.ˮ��
D.����ʯ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������к��зḻ�ĵ�Ԫ�ء���ͼ��ʵ���ҴӺ�������ȡ������̵�һ���֡������ж���ȷ����
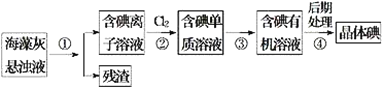
A. ����ܵIJ����ǹ���
B. ���õ�����Һ���鲽��ڵķ�Ӧ�Ƿ������ȫ
C. ����١��۵IJ����ֱ��ǹ��ˡ���ȡ
D. ������м�����л��ܼ������Ǿƾ������Ȼ�̼
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ڵ���ʵ��ǣ�������
A.���ᱵ
B.�Ȼ�����Һ
C.��������
D.����ͭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڳ�����pH=1��������Һ���й�������
�ٸ���Һ1mLϡ����100mL��pH=3
�������Һ�м���������pH=13������������Һǡ����ȫ�к�
�۸���Һ������������c(H+)��ˮ�������c(H+)֮��ֵΪ1��10��12
�������Һ�м�����������Ũ�ȵİ�ˮ��������ҺpH=7
������ȷ����
A. �٢� B. �٢� C. �ڢ� D. �ۢ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com