
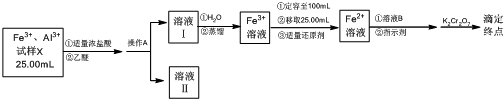
分析 含Fe3+、Al3+试样X溶液25ml,加入适量浓盐酸和乙醚,在较高的盐酸浓度下,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]而溶于乙醚,乙醚微溶于水,分层后通过分液分离得到溶液Ⅱ为Al3+的溶液,和溶液Ⅰ是乙醚形成化合物[(C2H5)2OH][FeCl4]的溶液,当盐酸浓度降低时,该化合物解离,加入水解离后,通过蒸馏得到方法除去乙醚,得到含铁离子的水溶液,定容至100ml,取25.00ml溶液,滴入适量还原剂得到Fe2+离子的溶液,加入指示剂,滴定前,加入的适量溶液B为非氧离子化性和还原性的酸,用重铬酸钾溶液滴定至终点,
(1)分离不溶于水的液体混合物利用分液的方法进行分离操作;
(2)依据铁离子遇到KSCN溶液变红色设计实验检验铁离子的存在;
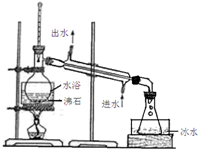
(3)蒸馏装置中锥形瓶不能密闭,乙醚是一种易挥发、易燃、有麻醉性的有机化合物,实验加热不能用明火;
(4)滴定需要的酸性环境,所需酸不能具有还原性、氧化性,不能被氧化剂氧化,也不能被亚铁离子还原;
(5)依据离子反应定量关系计算;
(6)上述测定结果存在一定的误差,为提高该滴定结果的精密度和准确度,可以重复几次实验,数值取平均值,减少误差,滴定溶液浓度越小,测定结果越准确.
解答 解:含Fe3+、Al3+试样X溶液25ml,加入适量浓盐酸和乙醚,在较高的盐酸浓度下,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]而溶于乙醚,乙醚微溶于水,分层后通过分液分离得到溶液Ⅱ为Al3+的溶液,和溶液Ⅰ是乙醚形成化合物[(C2H5)2OH][FeCl4]的溶液,当盐酸浓度降低时,该化合物解离,加入水解离后,通过蒸馏得到方法除去乙醚,得到含铁离子的水溶液,定容至100ml,取25.00ml溶液,滴入适量还原剂得到Fe2+离子的溶液,加入指示剂,滴定前,加入的适量溶液B为非氧离子化性和还原性的酸,用重铬酸钾溶液滴定至终点,
(1)操作A是利用在较高的盐酸浓度下,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]而溶于乙醚,乙醚微溶于水,分层后通过分液分离得到溶液Ⅱ为Al3+的溶液,和溶液Ⅰ是乙醚形成化合物[(C2H5)2OH][FeCl4]的溶液,分离的名称为分液,
故答案为:分液;
(2)依据铁离子遇到KSCN溶液变红色设计实验检验铁离子的存在,从溶液Ⅱ中取样,滴加KSCN溶液,显红色证明残留含有Fe3+,显无色证明无残留,
故答案为:从溶液Ⅱ中取样,滴加KSCN溶液,显红色证明残留含有Fe3+,显无色证明无残留;
(3)蒸馏装置中锥形瓶不能密闭,否则蒸馏实验不能进行,乙醚是一种易挥发、易燃、有麻醉性的有机化合物,实验加热不能用明火,否则会引发燃烧导致危险,
故答案为:体系密闭,明火加热;
(4)滴定需要的酸性环境,所需酸不能具有还原性、氧化性,不能被氧化剂氧化,也不能被亚铁离子还原,
A.H2SO3-H3PO4 中亚硫酸具有还原性,也会被氧化剂氧化,消耗标准溶液增大,产生误差,故A错误;
B.H2SO4-H3PO4 中酸为非氧化性酸,可以提供酸性环境且不影响测定反应,故B正确;
C.HNO3-H3PO4 中硝 酸具有强氧化性,可以氧化亚铁离子,导致滴入氧化剂标准溶液减少,测定结果偏低,故C错误;
D.HI-H3PO4 中HI酸是还原性酸,也可以消耗滴入的氧化剂,导致测定结果偏高,故D错误;
故答案为:B;
(5)依据离子反应定量关系计算,定达到终点时,消耗0.1000 mol•L-1K2Cr2O7溶液6.00mL,物质的量=0.1000mol/L×0.00600L=0.00060mol
反应为 Cr2O7 2-+6Fe2++H+=2Cr3++6Fe3++7H2O
1 6
0.00060mol 0.00360mol
c=$\frac{0.00360mol}{0.0250L}$=0.144mol/L
则试样X中c(Fe3+)=0.144mol/L×$\frac{100}{25}$=0.576mol/L,
故答案为:0.576mol/L;
(6)上述测定结果存在一定的误差,为提高该滴定结果的精密度和准确度,可以重复几次实验,数值取平均值,减少误差,滴定溶液浓度越小,测定结果越准确,
A.稀释被测试样,浓度减小,测定误差会增大,故A错误;
B.减少被测试样取量,和滴定结果的精密度和准确度无关,故B错误;
C.增加平行测定次数,减少测定带来的误差,可以提高准确度,故C正确;
D.降低滴定剂浓度,反应终点判断更准确.滴定结果的精密度高,故D正确;
故答案为:CD.
点评 本题考查了物质组成和成分探究实验过程分析,化合物分离、离子检验、实验基本操作、滴定实验过程和计算分析等知识点,注意题干信息的应用,题目难度中等.


科目:高中化学 来源: 题型:选择题

| A. | 步骤X中可用MnO2代替双氧水 | |
| B. | 步骤Y中所用的玻璃仪器一定有分液漏斗 | |
| C. | 步骤Y中可用酒精代替CCl4 | |
| D. | 由于碘易升华,步骤Z中不能采取加热蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
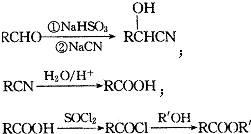 ;
;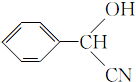 ;
; ;
;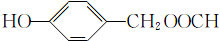 (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
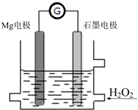 Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下.下列说法不正确的是( )
Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下.下列说法不正确的是( )| A. | 石墨电极是该电池的正极 | |
| B. | 石墨电极上发生还原反应 | |
| C. | Mg电极的电极反应式:Mg-2e-=Mg2+ | |
| D. | 电池工作时,电子从Mg电极经导线流向石墨电极,再出石墨电极经电解质溶液流向Mg电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该固体中一定含有NH4+、CO32-、SO42-、Na+ | |
| B. | 该固体中一定没有Cu2+、Cl-、Na+ | |
| C. | 该固体中只含有NH4+、CO32-、SO42-、Cl- | |
| D. | 根据以上实验,无法确定该固体中有Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,在0.10mol•L-1CH3COOH溶液中加入少量CH3COONa晶体,能使CH3COOH的电离度降低,溶液的pH增大 | |
| B. | 常温下向氯化铵溶液中加入少量氨水使溶液中c(NH4+)=c(Cl-),则混合液的pH=7 | |
| C. | 已知草酸氢钾溶液呈酸性,则在0.1 mol•L-1KHC2O4溶液中c(C2O42-)>c(K+)>c(H2C2O4) | |
| D. | pH=3的0.1 mol•L-1HA溶液与0.05 mol•L-1NaOH溶液等体积混合后所得溶液中:2c(H+)+c(HA)=c(A-)+2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
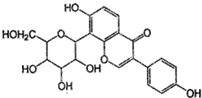
| A. | 该物质在一定条件下能发生消去反应、加成反应、取代反应 | |
| B. | 葛根素的分子式为C21H22O9 | |
| C. | 一定条件下1mol 该物质与浓溴水反应最多能消耗3mol Br2 | |
| D. | 一定条件下1mol 该物质与H2反应最多能消耗7mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O | |
| B. | 向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| C. | 氧化亚铁溶于稀硝酸:3FeO+8H++NO3-═3Fe3++NO↑+4H2O | |
| D. | 将0.4 mol•L-1的NaAlO2溶液和0.7 mol•L-1的盐酸等体积混合:4AlO${\;}_{2}^{-}$+7H++H2O═3Al(OH)3↓+Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

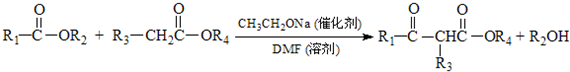
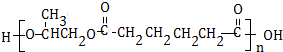 .
.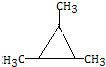 .
.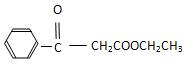
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com