
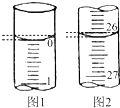
 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L 盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | ① | ② |
| 第二次 | 25.00 | 1.56 | 27.68 | 26.12 |
| 第三次 | 25.00 | 0.22 | 26.30 | 26.08 |
| c(标准)×c(标准) |
| V(待测) |
| c(标准)×c(标准) |
| V(待测) |
| c(标准)×c(标准) |
| V(待测) |
| c(标准)×c(标准) |
| V(待测) |
| c(标准)×c(标准) |
| V(待测) |
| 0.02609L×0.1000mol/L |
| 0.025L |


科目:高中化学 来源: 题型:
| 溶质 | 加入试剂 | 离子方程式 |
| Cu2+ | ||
| SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲酸(CH2O2),俗称蚁酸,结构式为:
甲酸(CH2O2),俗称蚁酸,结构式为: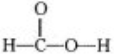 .某化学兴趣小组的同学在分析甲酸的组成和结构后,对甲酸的性质提出如下猜想并设计了相关实验加以验证:
.某化学兴趣小组的同学在分析甲酸的组成和结构后,对甲酸的性质提出如下猜想并设计了相关实验加以验证:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到沉淀.
某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到沉淀.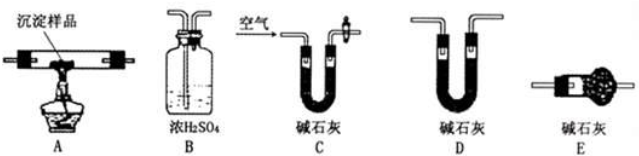
查看答案和解析>>
科目:高中化学 来源: 题型:
| r+/r- | 配位数 | 实例 |
| 0.225~0.414 | 4 | ZnS |
| 0.414~0.732 | 6 | NaCl |
| 0.732~1.0 | 8 | CsCl |
| >1.0 | 12 | CsF |
| A、该晶体结构与ZnS晶体相似 | |||||
| B、该晶体每个晶胞中有2个A2+和B2- | |||||
C、该晶体晶胞的边长
| |||||
| D、A2+离子紧邻的B2-构成的空间结构为正方体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
| B、沉淀溶解后,将生成深蓝色的配离子[Cu(NH3)4]2+ |
| C、向反应后的溶液加入乙醇,溶液将会没有发生任何变化,因[Cu(NH3)4]2+不会与乙醇发生反应 |
| D、在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H4与C4H8,体比为17:53 |
| B、C2H2与C4H8,体积比为17:58 |
| C、C3H6与C4H6,体积比为2:3 |
| D、C2H4与C4H8,体积比为17:23 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇结构中有-OH,其水溶液可以电离出OH-而显碱性 |
| B、乙醇与乙酸在一定条件下反应生成乙酸乙酯 |
| C、乙醇与钠反应可以产生氢气,所以乙醇显酸性 |
| D、乙醇与钠反应比较平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com