
【题目】已知A是一种气态烃.完全燃烧时产生的水和二氧化碳的物质的量之比为1:1.A的相对分子质量小于30.在下图变化中,中间产物C能和新制的氢氧化铜反应生成砖红色沉淀.(反应条件未写出)
又知2CH3CHO+O2![]() 2CH3COOH.请回答下列问题:
2CH3COOH.请回答下列问题:
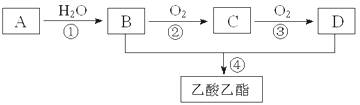
(1)写出A的电子式________
(2)B、D分子内含有的官能团分别是________、________(填名称);
(3)判断下列反应的反应类型:①______________,③______________
(4)写出下列反应的化学方程式:②________________________________________;
(5)下列说法正确的是________。
A.有机物B与金属钠反应,现象是钠浮在液面,不停的游动,最后消失。
B.有机物B、D以及乙酸乙酯可用饱和Na2CO3溶液鉴别
C.反应④中,浓硫酸主要起氧化作用
D.有机物C能被新制碱性氢氧化铜悬浊液、酸性KMnO4溶液氧化
【答案】![]() 羟基 羧基 加成反应 氧化反应 2CH3CH2OH+O2
羟基 羧基 加成反应 氧化反应 2CH3CH2OH+O2![]() 2CH3CHO+2H2O BD
2CH3CHO+2H2O BD
【解析】
A是气态烃,完全燃烧时产生的CO2和H2O的物质的量之比为1:1,所以A中C、H原子个数比为1:2,A的相对分子量小于30,所以A是乙烯;中间产物C能和新制氢氧化铜悬浊液产生砖红色沉淀说明C含有醛基,所以C是乙醛,则B是乙醇;乙醇和D反应生成乙酸乙酯,所以D为乙酸,根据题目要求回答问题。
(1)乙烯中含碳碳双键和碳氢单键,电子式为![]() ,
,
故答案为:![]() ;
;
(2)B为乙醇,结构简式为:CH3CH2OH,含官能团为羟基;D为乙酸,结构简式为:CH3COOH,含官能团羧基,
故答案为:羟基;羧基;
(3)乙烯和水生成乙醇的反应是加成反应,乙醛发生催化氧化生成乙酸,为氧化反应,
故答案为:加成反应,氧化反应;
(4)在催化剂、加热条件下,乙醇被氧气氧化生成乙醛,所以反应②的方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
故答案为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(5)A.B为乙醇,钠的密度比乙醇大,乙醇与金属钠反应时,钠沉在下面,故A错误。
B.乙醇和Na2CO3溶液不反应,也不分层,乙酸Na2CO3溶液反应有气泡产生,乙酸乙酯不溶于饱和Na2CO3溶液,所以可用饱和Na2CO3溶液鉴别三种物质,故B正确;
C.在乙酸和乙醇发生的酯化反应中,浓硫酸起催化剂和脱水剂的作用,故C错误;
D.乙醛分子中含有醛基,能被新制碱性氢氧化铜悬浊液、也能被酸性KMnO4溶液氧化,故D正确。
故选BD。


科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确( )
A. 烧碱溶液与氯化铵溶液混合: NH4++OH- = NH3·H2O
B. 硫酸铵溶液与氢氧化钡溶液混合加热:NH4++OH- = NH3↑+H2O
C. 氨气通入稀硫酸:NH3+H+=NH4+
D. 氯气通入水中:Cl2 + H2O = 2H++Cl-+ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在周期表中相对位置如下图所示,若Y原子的最外层电子是次外层电子数的3倍,下列说法正确的是( )
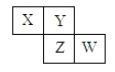
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 4种元素的单质中,Z单质的熔沸点最低
D. W单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸是二元弱酸,0.2 mol·L-1NaHC2O4溶液显酸性,关于NaHC2O4溶液中离子浓度关系的叙述不正确的是( )
A.c(Na+)>c(HC2O4—)>c(C2O42—)>c(H2C2O4)
B.c(Na+)=c(HC2O4—)+c(C2O42—)+c(H2C2O4)
C.c(Na+)+c(H+)=c(HC2O4—)+c(C2O42—)+c(OH-)
D.c(H+)+c(H2C2O4)=c(C2O42—)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。

请回答下列问题:
(1)写出下列物质的化学式:B_____________、丙____________;
(2)写出下列反应的化学方程式;
反应①_________________________________________________________________;
反应③_________________________________________________________________;
反应⑤_________________________________________________________________;
(3)向F的溶液中加入D溶液后产生的现象是________________________________,并用化学反应方程式解释产生此现象的原因____________________、_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应属于取代反应的是
A. 甲烷在空气中燃烧
B. 乙烯通入溴水中
C. 乙醇与乙酸在浓硫酸催化加热的条件下反应
D. 在镍做催化剂的条件下,苯与氢气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为 。
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为 (已知该反应为置换反应).
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有化学键的类型为 ,K的原子结构示意图为 。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为 。
(5)100g上述产气药剂产生的气体通过碱石灰后得到N2 33.6L(标准状况)。
①用碱石灰除去的物质为 ;
②该产气药剂中NaN3的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的氨基甲酸铵固体置于特制的密闭真空容器中(容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。实验测得不同温度下的部分平衡数据如下表:
2NH3(g)+CO2(g)。实验测得不同温度下的部分平衡数据如下表:
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强/kPa | 5.7 | p1 | 12.0 | p2 | 24.0 |
平衡气体总浓度/10-3 mol·L-1 | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
下列说法中不正确的是
A. 混合气体的平均相对分子质量——M不再随时间变化时反应达平衡状态
B. 15.0 ℃时NH2COONH4(s)分解的平衡常数为2.0×10-9(mol/L)3
C. 该反应H>0,p2=2p1
D. 若在恒温下将平衡体系体积减半,再达平衡后,c(NH3)和c(CO2)均比原平衡大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
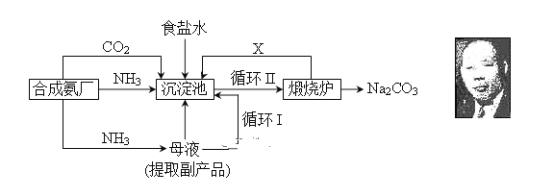
(1) 上述生产纯碱的方法称________________,副产品的一种用途为____________。
(2) 沉淀池中发生的化学反应方程式是____________________________________。
(3) 写出上述流程中X物质的分子式________________。
(4) 使原料氯化钠的利用率从70%提高到90%以上,主要是设计了________(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是____________。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加________________________________________________________。
(6) 向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有_________。
(a) 增大NH4+的浓度,使NH4Cl更多地析出
(b) 使NaHCO3更多地析出
(c) 使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com