
【题目】下列物质中,既有离子键,又有共价键的是( )
A.CaCl2
B.KOH
C.H2O
D.N2
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列对教材中有关数据的叙述不正确的是![]()
![]()
A. 利用沸点数据可以推测将一些液体混合物分离开来的可能性
B. 通过比较溶度积常数![]() 与溶液中有关离子浓度幂的乘积--离子积
与溶液中有关离子浓度幂的乘积--离子积![]() 的相对大小,可以判断难溶电解质在给定条件下能否生成或溶解
的相对大小,可以判断难溶电解质在给定条件下能否生成或溶解
C. 利用溶液的pH与7的大小关系,可以判断任何温度下溶液的酸碱性
D. 根据分散质粒子直径的大小,可以判断分散系的类别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z原子序数依次增大,甲、乙、丙、丁均是由前3种元素组成的二元“10电子”微粒,能发生如图转化,Z的原子半径是所有短周期主族元素中最大的,下列说法错误的是
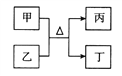
A. 原子半径大小:W<Y<X<Z
B. W、X、Y三种元素形成的化合物水溶液一定显酸性
C. W、X、Y与Z均能形成离子化合物
D. Y分别与其他三种元素至少可以形成两种化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在做实验时引发了镁失火,她立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧,发生2Mg+CO2![]() 2MgO+C,下列关于该反应的判断正确的是( )
2MgO+C,下列关于该反应的判断正确的是( )
A. Mg元素化合价由0价升高到+2价,所以MgO是还原产物
B. 由此反应可以判断氧化性:CO2>MgO,还原性:Mg>C
C. CO2作氧化剂,表现氧化性,发生氧化反应
D. Mg原子失去的电子数目等于氧原子得到的电子数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,2.24L三氯甲烷中所含分子数为NA
B. 1molH2与1molI2(g)于密闭容器中反应,生成的H-I键数为2NA
C. 常温下,0.1molFe投入到足量浓硫酸中反应,转移的电子数为0.3NA
D. 8.8g乙酸乙酯和乙醛(CH3CHO)的混合物中含有的C原子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸盐和金属硫化物在工农业生产中有广泛的应用。
(1)已知:
反应Ⅰ:CaSO4(s)+CO(g)=CaO(s)+SO2(g)+CO2(g)△H1=+218.4 kJ·mol-1
反应Ⅱ:CaSO4(s)+4CO(g)=CaS(s)+4CO2(g) △H2=-175.6kJ·mol-1
反应 Ⅲ:3CaSO4(s)+CaS(s)=4CaO(s)+4SO2(g) (B) △H3
①△H3=__________。
②能使反应Ⅰ、Ⅱ速率加快的措施有____________________________________(写出两条)。
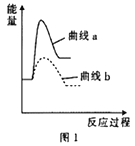
③已知某温度下反应Ⅰ的反应速率小于反应Ⅱ的反应速率,则图1中曲线a表示__________ (填“反应Ⅰ”或“反应Ⅱ”)。
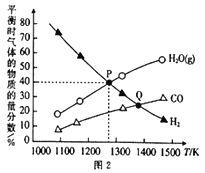
(2)在2L密闭容器中,加入0.1molMoS2(硫化钼)、0.2molNa2CO3和0.4molH2,发生反应MoS2(s)+2Na2CO3 (s)+4H2(g)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),达到平衡时三种气体的物质的量分数随温度变化的曲 线如图2所示。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),达到平衡时三种气体的物质的量分数随温度变化的曲 线如图2所示。
①反应速率:P点______ Q点(填“<” “>”或“=”),其判断理由是_____________。
②气体总压:P点__Q点(填“<” “>”或“=”),其判断理由是_____________。
③P点对应温度下,H2的平衡转化率为__________,平衡常数K=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列 11 种物质:
①纯碱 ②Mn2O7 ③硫酸 ④CaO ⑤CO2 ⑥Na2CO3
⑦CuSO4·5H2O ⑧SO2 ⑨Na2O2 ⑩CO NO2
其中属于正盐的是______________;属于酸性氧化物的是__________________。
(2)有关胶体的实验中:
①实验室制备Fe(OH)3胶体的化学方程式为_________
②将橘红色的硫化锑(Sb2S3)胶体,装入U形管,插入电极后通直流电,发现阳极负极橘红色加深,证明Sb2S3胶粒带______(填“正”或“负”)电荷。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com