
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
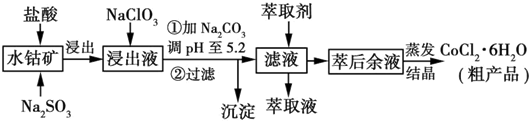
分析 含钴废料中加入盐酸和亚硫酸钠,可得CoCl2、AlCl3、FeCl2、MnCl2,加入NaClO3氧化亚铁离子为铁离子,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MnCl2,然后加入萃取剂除去Mn2+等,萃取后溶液经过蒸发结晶得到CoCl2•6H2O.
(1)Co2O3与盐酸反应生成与CoCl2与水,Co3+将亚硫酸根氧化为硫酸根,自身被还原为Co2+;
(2)NaClO3具有氧化性,能将浸出液中的Fe2+氧化成Fe3+;
(3)加Na2CO3调pH至5.2所得沉淀为氢氧化铁、氢氧化铝;
(4)滤液Ⅱ中加入萃取剂的作用是除去锰离子,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀;
(5)粗产品含有可溶性氯化物或晶体失去部分结晶水.
解答 解:含钴废料中加入盐酸和亚硫酸钠,可得CoCl2、AlCl3、FeCl2、MnCl2,加入NaClO3氧化亚铁离子为铁离子,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MnCl2,然后加入萃取剂除去Mn2+等,萃取后溶液经过蒸发结晶得到CoCl2•6H2O.
(1)Co2O3与盐酸反应生成与CoCl2与水,Co3+将亚硫酸根氧化为硫酸根,自身被还原为Co2+,反应离子方程式为:Co2O3+SO32-+4H+═2Co2++SO42-+2H2O,
故答案为:Co2O3+SO32-+4H+═2Co2++SO42-+2H2O;
(2)NaClO3具有氧化性,能将浸出液中的Fe2+氧化成Fe3+,以便后续步骤中调节溶液pH转化为氢氧化铁除去,
故答案为:将Fe2+氧化成Fe3+;
(3)加Na2CO3调pH至5.2所得沉淀为Fe(OH)3、Al(OH)3,
故答案为:Fe(OH)3、Al(OH)3;
(4)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子,由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,
故答案为:除去溶液中的Mn2+;B;
(5)粗产品含有可溶性氯化物或晶体失去部分结晶水,使沉淀粗产品中CoCl2•6H2O的质量分数大于100%,
故答案为:粗产品含有可溶性氯化物或晶体失去部分结晶水.
点评 本题属于化学工艺流程题目,涉及物质分离和提纯、对操作与药品的分析评价、元素化合物知识、含量测定误差分析、信息获取与迁移运用等,关键是理解工艺流程,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③ | C. | ③④ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3溶液 | B. | Ba(OH)2溶液 | C. | H2SO4溶液 | D. | HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发 | B. | 萃取 | C. | 液体过滤 | D. | 升华 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外小组分别用图所示装置对原电池和电解池原理进行实验探究.
某课外小组分别用图所示装置对原电池和电解池原理进行实验探究.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 不同时间各物质的物质的量/mol | ||||
| 0min | 2min | 4min | 6min | |
| CH4 | 2.00 | 1.76 | 1.60 | n2 |
| H2 | 0.00 | 0.72 | n1 | 1.20 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 加热碳酸氢钠固体时,试管管口倾斜向上 | |
| C. | 实验室制取氯气时,用NaOH溶液进行尾气吸收 | |
| D. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com