
【题目】三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷,它受热易分解,为了验证其气态产物,某同学设计了如下实验装置:
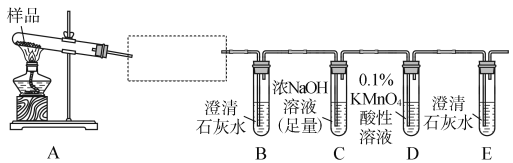
(1)若实验中,观察到B、E中的溶液均变浑浊,则D中的现象是_______________________;
说明其气态产物是________、________;为验证另一种气态产物,应在A、B之间增加的装置为________。
(2)为了使实验更安全、更严密,你认为该实验设计需要如何改进?
①______________________________;
②__________________________________。
(3)固体产物中铁元素不可能以+3价形式存在,理由是___________________________。
现设计实验,探究固体产物中铁元素的存在形式。
①提出合理假设。
假设1:_________________________________;
假设2:_________________________________;
假设3:_________________________________。
②某学生设计实验探究上述假设,除3%H2O2、蒸馏水外,还需要下列试剂中的____________________________。
限选试剂:浓硫酸、1.0 mol·L-1HNO3、1.0 mol·L-1盐酸、1.0 mol·L-1NaOH溶液、0.1 mol·L-1KI溶液、0.1 mol·L-1CuSO4溶液、20%KSCN溶液。
【答案】(1)溶液褪色(或变浅) CO2 CO 盛有无水CuSO4的干燥管
(2)①在B装置之前加一个防倒吸装置 ②在C装置后增加一个检验二氧化碳是否除尽的装置(或盛有澄清石灰水的试管)
(3)有还原性气体CO生成,能将三价铁还原,故不可能有三价铁存在
①铁元素的存在形式为Fe单质 铁元素的存在形式为FeO 铁元素的存在形式为Fe与FeO的混合物
②1.0 mol·L-1盐酸、20%KSCN溶液、0.1 mol·L-1CuSO4溶液
【解析】(1)B中溶液变浑浊说明气态产物中有CO2,E中溶液变浑浊说明CO被酸性高锰酸钾溶液氧化为CO2,故D中的现象是溶液褪色或变浅,从而可说明气态产物中有CO;另一种气态产物是H2O,其验证方法是将A中产生的气体通过盛有无水CuSO4的干燥管。(2)从安全角度考虑应在B装置前加一个防倒吸装置,从严密性角度考虑,要在C装置后增加一个检验CO2是否除尽的装置。(3)①由于反应过程中有CO生成,能还原三价的铁,故固体产物中无三价铁,其成分可能有三种情况:Fe、FeO、Fe和FeO。②探究固体产物中铁元素的存在形式,可以将固体产物放入足量的0.1 mol·L-1的CuSO4溶液中搅拌使其充分反应,然后过滤洗涤沉淀,再加入足量的1.0 mol·L-1的盐酸,若溶液中有不溶的红色物质,则说明固体产物中含有Fe(发生反应为Fe+CuSO4===FeSO4+Cu),向溶液中加入20%KSCN溶液,不变红色,然后再向溶液中滴加双氧水,若变红色,则说明固体产物中含有FeO。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)写出浓硫酸与木炭粉在加热条件下反应的化学方程式 _。
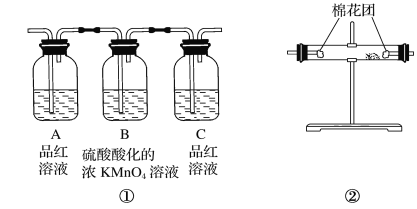
(2)试用上图所示各装置设计一个实验,验证上述反应所产生的各种产物。这些装置的连接顺序(按产物气体从左至右的流向)是________→________→________→________(填装置的编号)。
(3)怎样检查整套装置的气密性
(4)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色,A瓶溶液的作用是________,B瓶溶液的作用是________,C瓶溶液的作用是________。
(5)装置②中所加的固体药品是________,可验证的产物是________。
(6)装置③中所盛溶液是________,可验证的产物是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气用于自来水的杀菌消毒,但在消毒时会产生一些负面影响,因此人们开始研究一些新型自来水消毒剂。某学习小组查阅资料发现NCl3可作为杀菌消毒剂,该小组利用下图所示的装置制备NCl3,并探究NCl3的漂白性。

NCl3的相关性质如下:
物理性质 | 制备原理 | 化学性质 |
黄色油状液体,熔点为-40℃,沸点为71℃,不溶于冷水,易溶于有机溶剂,密度为1.65 g/mL | Cl2与NH4Cl水溶液在低温下反应 | 95℃爆炸,热水中能与水反应 |
回答下列问题:
根据实验目的,接口连接的顺序为
1→ → →2→3 →6→7→ → → 。
(2)C装置作用是 。
(3)B装置中发生反应的化学方程式为 ,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为 。
(4)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50-60℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,写出有关化学反应方程式并解释实验现象: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列物质用途的解释不正确的是
A | B | C | D | |
用途 | 抗坏血酸(Vc)可作抗氧化剂 | 明矾可用于净水 | 纯碱可去油污 | “84”消毒液可用于漂白 |
解释 | Vc具有酸性 | 明矾在水中生成的氢氧化铝胶体具有吸附性 | 纯碱水解呈碱性 | 置于空气中生成的次氯酸有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用H++OH﹣=H2O表示的化学方程式是( )
A.氢氧化钠溶液与醋酸反应
B.氢氧化铁与硫酸反应
C.氢氧化钡与硫酸反应
D.硫酸氢钠与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组同学向一定量加入少量淀粉的NaHSO3溶液中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色。
(1)查阅资料知,NaHSO3与过量KIO3反应分为两步进行,第一步为IO![]() +3HSO
+3HSO![]() ===3SO
===3SO![]() +3H++I-,则第二步反应的离子方程式为________________________。
+3H++I-,则第二步反应的离子方程式为________________________。
(2)通过测定溶液变蓝所用时间探究浓度和温度对该反应的反应速率的影响。调节反应物浓度和温度进行对比实验,记录如下:
实验编号 | 0.02 mol/L NaHSO3溶液/mL | 0.02 mol/L KIO3溶液/mL | H2O/mL | 反应温度/℃ | 溶液变蓝的时间t/s |
① | 15 | 20 | 10 | 15 | t1 |
② | a | 30 | 0 | 15 | t2 |
③ | 15 | b | c | 30 | t3 |
实验①②是探究____________对反应速率的影响,表中a=________;实验①③是探究温度对反应速率的影响,则表中b=________,c=________。
(3)将NaHSO3溶液与KIO3溶液混合(预先加入可溶性淀粉为指示剂),用速率检测仪检测出起始阶段反应速率逐渐增大,一段时间后反应速率又逐渐减小。课题组对起始阶段反应速率逐渐增大的原因提出如下假设,请你完成假设三:
假设一:反应生成的SO![]() 对反应起催化作用,SO
对反应起催化作用,SO![]() 浓度越大反应速率越快;
浓度越大反应速率越快;
假设二:反应生成的H+对反应起催化作用,H+浓度越大反应速率越快;
假设三:__________________________;
……
(4)请你设计实验验证上述假设一,完成下表中内容(反应速率可用测速仪测定)。
实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于氧化还原反应同时又是吸热反应的是
A.Ba(OH)2·8H2O与NH4Cl反应
B.铝与稀盐酸
C.灼热的炭与水蒸气生成一氧化碳和氢气的反应
D.煤与O2的燃烧反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com