
| A. | XO3- | B. | XO32- | C. | XO42- | D. | XO43- |
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:填空题
| A | ||
| B | C | D |
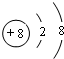
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


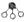 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s22s22p4 | B. | 1s22s22p63s23p3 | ||
| C. | 1s22s22p3 | D. | 1s22s22p63s23p64s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ZnCl2既是氧化产物,又是还原产物 | |
| B. | ICl跟H2O的反应是自身氧化还原反应 | |
| C. | ZnI2既是氧化产物,又是还原产物 | |
| D. | 在ICl跟H2O的反应中,ICl是氧化剂,H2O是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原固体混合物中NaHCO3的物质的量为0.2mol | |
| B. | 固体残渣的成分为NaOH和Na2CO3的混合物 | |
| C. | 原固体混合物中NaOH和NaHCO3的物质的量之比为2﹕5 | |
| D. | 原固体混合物中加入过量盐酸会放出5.6L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溶液中加入石蕊试液后,呈蓝色 | |
| B. | 向溶液中加入酚酞试液后,呈红色 | |
| C. | 将溶液在试管中加热至沸腾,试管口放置的红色石蕊试纸变蓝色 | |
| D. | 将溶液中加入过量烧碱溶液加热至沸腾,试管口放置的红色石蕊试纸变蓝色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com