
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,11.2 L Cl2溶于水,溶液中Cl-,ClO-和HClO的微粒数之和为NA
B.32.5 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.2NA
C.1 mol PC13与1 mol 36C12反应达到平衡时,产物中含P—36C1键数目为2NA
D.反应![]() +
+ ![]() →
→ ![]() +
+ ![]() 中,每生成294g
中,每生成294g ![]() 释放的中子数为3NA
释放的中子数为3NA
【答案】D
【解析】
A选项,标准状况下,11.2 L Cl2物质的量为0.5mol,氯气与水反应是可逆反应,根据物料守恒得出溶液中Cl-,ClO-和HClO的微粒数之和小于NA,故A错误;
B选项,32.5 g FeCl3物质的量为0.2mol,其水解形成Fe(OH)3胶体,胶体粒子是聚合体,因此胶体粒子数小于0.2NA,故B错误;
C选项,1 mol PC13与1 mol 36C12反应达到平衡时,反应是可逆反应,产物PC15的物质的量小于1mol,因此PC15中含P—36C1键数目小于为2NA,故C错误;
D选项,根据反应式知x=3,即反应![]() +
+ ![]() →
→ ![]() +
+ ![]() 中,每生成294g
中,每生成294g ![]() 即1mol,则释放的中子数为3NA,故D正确;
即1mol,则释放的中子数为3NA,故D正确;
综上所述,答案为D。


科目:高中化学 来源: 题型:
【题目】中华人民共和国国家标准(G2762011)规定葡萄酒中SO2最大使用量为0.25g·L1,取300.00mL葡萄酒,通过适当的方法使所含SO2全部逸出并用H2O2将其全部氧化为H2SO4,然后用0.0900mol·L-1NaOH标准溶液进行滴定。
(1)滴定前排气泡时,应选择图中的___(填序号)。


(2)若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积___(填序号)。
a.=10mL b.=40mL c.<10 mL d.>40mL
(3)上述滴定实验中,可选择___为指示剂,选择该指示剂时如何判断反应到达滴定终点:___。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为___g·L1。滴定终点读数时俯视刻度线,则测量结果比实际值___(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,浓度均为
时,浓度均为![]() 的HA溶液和BOH溶液,pH分别是1和11。下列说法正确的是
的HA溶液和BOH溶液,pH分别是1和11。下列说法正确的是![]()
A.BOH溶于水,其电离方程式是![]()
B.在![]()
![]() 溶液中,
溶液中,![]()
C.若一定量的上述两溶液混合后![]() ,则
,则![]()
D.若将![]()
![]() 溶液稀释至
溶液稀释至![]()
![]() ,则溶液的
,则溶液的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应与能量变化的说法正确的是

A.甲烷的燃烧热△H=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+![]() O2(g)=CO(g)+2H2O(g) ΔH=-890.3kJ·mol-1
O2(g)=CO(g)+2H2O(g) ΔH=-890.3kJ·mol-1
B.相同条件下,氢气和氧气反应生成液态水比生成等量的气态水所放出的热量少
C.根据右图金刚石在一定条件下转化成石墨提供的信息,可知生成物比反应物稳定,向外界放出的热量为E2 -E3
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质间常常相互联系、互相影响中,微粒也不例外。下列各组离子可能大量共存的是![]()
A.常温下水电离出的![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
B.不能使酚酞试液变红的无色溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
C.能与金属铝反应放出氢气的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
D.无色透明溶液:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述不正确的是( )
A. 含有氢原子数为0.4NA的CH3OH分子中含有的共价键数目为0.5NA
B. a g某气体含分子数为b,c g该气体在标准状况下体积为![]() L
L
C. 电解饱和食盐水,阳极产生22.4 L气体时,电路中通过的电子数目为2NA
D. 常温下,1.0 L pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中原子数相同的是( )
A.2LCO和2LN2
B.9gH2O和标准状况下11.2LCO2
C.标准状况下1molO2和22.4LH2O
D.0.2molNH3和4.48LHCl气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:

回答下列问题:
(1)在95 ℃“溶侵”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为_________。
(2)“滤渣1”的主要成分有_________。为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学试剂是_________。
(3)根据H3BO3的解离反应:H3BO3+H2O![]() H++B(OH)4,Ka=5.81×1010,可判断H3BO3是_______酸;在“过滤2”前,将溶液pH调节至3.5,目的是_______________。
H++B(OH)4,Ka=5.81×1010,可判断H3BO3是_______酸;在“过滤2”前,将溶液pH调节至3.5,目的是_______________。
(4)在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为__________,母液经加热后可返回___________工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”(IYPT2019)。我国华东师范大学80后科学家姜雪峰教授被遴选为硫元素的代言人。其课题组运用“从无机硫向有机硫”转化的理念,构建起了“3S绿色硫化学”。下列有关S的说法正确的是( )
A.位于元素周期表中第三周期第VA族
B.硫元素原子结构示意图: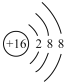
C.![]() S原子的中子数是32
S原子的中子数是32
D.有机化合物中可能含有硫元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com