
| A. | ①②③④⑤⑥⑦⑧ | B. | ①②⑤④③⑥⑦⑧ | C. | ①②⑤④③⑦⑥⑧ | D. | ⑥⑤④③②①⑦⑧ |
分析 一般来说,晶体熔沸点高低顺序是:原子晶体>离子晶体>分子晶体,原子晶体熔沸点与键长成反比,分子晶体熔沸点与相对分子质量成正比,但含有氢键的熔沸点较高,据此分析解答.
解答 解:一般来说,晶体熔沸点高低顺序是:原子晶体>离子晶体>分子晶体,原子晶体熔沸点与键长成反比,分子晶体熔沸点与相对分子质量成正比,但含有氢键的熔沸点较高,
SiC和Si是原子晶体,熔沸点较高,键长Si-C<Si-Si,所以熔沸点SiC>Si;
剩余这些物质都是分子晶体,且都不含氢键,相对分子质量大小顺序是⑤④③⑥⑦⑧,氮气为非极性分子、CO为极性分子,极性分子熔沸点高于非极性分子,
所以所有物质熔沸点高低顺序是①②⑤④③⑥⑦⑧,故选B.
点评 本题考查晶体熔沸点高低判断,侧重考查晶体类型判断及晶体熔沸点影响因素,熟悉常见晶体类型,注意化学键影响分子稳定性不影响分子晶体熔沸点高低,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
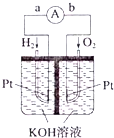 Ⅰ.甲硅烷(SiH4)常温下是一种无色气体,遇空气发生自燃.
Ⅰ.甲硅烷(SiH4)常温下是一种无色气体,遇空气发生自燃.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:X>Y>Z>W | |
| B. | Y的气态氢化物的热稳定性比W的强 | |
| C. | 原子半径的大小顺序:r(Z)>r(Y)>r(W)>r(X) | |
| D. | X分别与Y、Z形成的化合物中化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 | |
| B. | NH3为三角锥形,甲烷是正四面体形 | |
| C. | NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较弱 | |
| D. | NH3和CH4都是sp3型杂化,键角都是109°28′ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | ① | ② | ③ | ④ |
| pH | 10 | 10 | 4 | 4 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
| A. | 相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④ | |
| B. | 分别加水稀释10倍,四种溶液的pH①>②>④>③ | |
| C. | ①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | Va L ④溶液与Vb L ②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va :Vb=11:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
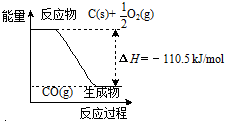
| A. | 12gC(s)与一定量O2(g)反应生成14g CO(g),放出的热量为110.5kJ | |
| B. | 该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差 | |
| C. | 该反应的热化学方程式是2C(s)+O2(g)=2CO(g)△H=-221kJ | |
| D. | 2molC(s)与足量O2(g)反应生成CO2(g),放出的热量大于221kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气极易溶于水,所得的氨水中存在3种不同的氢键 | |
| B. | [Ag(NH3)2]+ 中含有6个σ键 | |
| C. | [Ag(NH3)2]OH所含有的化学键有离子键、极性共价键和配位键 | |
| D. | 在[Ag(NH3)2]+离子中Ag+给出孤对电子,NH3提供空轨道 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com