
【题目】钛合金烤瓷牙是目前国内使用最为普遍的一种烤瓷牙,TiCl4是生产金属钛的原料.
(1)工业上主要用TiO2氯化的方法来制取TiCl4
①有人拟用以下氯化反应来制取TiCl4:TiO2(s)+2Cl2(g)TiCl4(l)+O2(g),写出实验室用二氧化锰与浓盐酸反应制取Cl2的离子方程式 .
②工业上通常往TiO2和Cl2反应体系中加入碳单质,在一定条件下制取TiCl4 , 从化学平衡的角度解释此方法能顺利制取TiCl4的原因 .
(2)某化学实验小组以TiO2和足量 CCl4为原料制取TiCl4 , 装置如图1所示: 
如表是有关物质的性质:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | ﹣23 | 76.8 | 与TiCl4互溶 |
TiCl4 | ﹣25 | 136 | 遇潮湿空气产生白雾 |
①实验开始时先点燃A处的酒精灯,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,其主要目的是 .
②本实验中仪器a采用题给的加热方式的突出优点是 .
③B中CCl4与TiO2发生反应的化学方程式是 .
④欲分离C装置中的TiCl4 , 应采用的实验操作为(填操作名称).
⑤若将反应过程中生成的气体X(足量)缓缓通入Ba( OH)2和NaOH的混合稀溶液中,生成沉淀的物质的量(n)和 通入气体X的体积(V)的关系如图2所示,若混合溶液中Ba( OH)2和2NaOH的物质的量之比为1:1,则b点溶液中溶质主要成分的化学式为 , 从b点到c点,沉淀减少过程中发生反应的离子方程式为 .
【答案】
(1)MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O;加入的碳单质与氧气反应,减小了产物O2的浓度,使 TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g)平衡向正反应方向移动,使反应能够顺利进行
Mn2++Cl2↑+2H2O;加入的碳单质与氧气反应,减小了产物O2的浓度,使 TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g)平衡向正反应方向移动,使反应能够顺利进行
(2)先排尽系统(装置)中的空气;受热均匀,能为反应提供稳定的CCl4蒸汽流;TiO2+CCl4 ![]() TiCl4+CO2↑;蒸馏;NaHCO3;BaCO3+H2O+CO2=Ba2++2HCO3﹣
TiCl4+CO2↑;蒸馏;NaHCO3;BaCO3+H2O+CO2=Ba2++2HCO3﹣
【解析】解:(1)①二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,反应离子方程式为:MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O,所以答案是:MnO2+4H++2Cl﹣
Mn2++Cl2↑+2H2O,所以答案是:MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O;②在反应TiO2(s)+2Cl2(g)TiCl4(l)+O2(g)中,加入C能和O2反应C(s)+O2(g)=CO2(g),降低了O2的浓度,平衡正向移动,反应就可以进行了,
Mn2++Cl2↑+2H2O;②在反应TiO2(s)+2Cl2(g)TiCl4(l)+O2(g)中,加入C能和O2反应C(s)+O2(g)=CO2(g),降低了O2的浓度,平衡正向移动,反应就可以进行了,
所以答案是:加入的碳单质与氧气反应,减小了产物O2的浓度,使 TiO2(s)+2Cl2(g)TiCl(l)+O2(g)平衡向正反应方向移动,使反应能够顺利进行;(2)为防止产品TiCl4被氧化,实验开始时先点燃A处的酒精灯,使四氯化碳挥发,排尽系统(装置)中的空气,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,B中装置在加热条件下,发生反应TiO2(s)+CCl4(g) ![]() TiCl4(g)+CO2(g),CCl4、TiCl4熔点较低,C装置使这两种物质转化为液态,二者能互溶,应该采用蒸馏方法分离,D装置连接空气,由于TiCl4遇潮湿空气产生白雾,发生水解反应,故D装置作用是防止空气中水蒸进入.①为防止产品TiCl4被氧化,先排尽系统(装置)中的空气,
TiCl4(g)+CO2(g),CCl4、TiCl4熔点较低,C装置使这两种物质转化为液态,二者能互溶,应该采用蒸馏方法分离,D装置连接空气,由于TiCl4遇潮湿空气产生白雾,发生水解反应,故D装置作用是防止空气中水蒸进入.①为防止产品TiCl4被氧化,先排尽系统(装置)中的空气,
所以答案是:先排尽系统(装置)中的空气;②水浴加热优点是受热均匀,能为反应提供稳定的CCl4蒸汽流,
所以答案是:受热均匀,能为反应提供稳定的CCl4蒸汽流;③TiO2和 CCl4为在加热条件下生成TiCl4和CO2 , 方程式为:TiO2+CCl4 ![]() TiCl4+CO2↑;
TiCl4+CO2↑;
所以答案是:TiO2+CCl4 ![]() TiCl4+CO2↑;④CCl4、TiCl4二者能互溶,应该采用蒸馏方法分离,
TiCl4+CO2↑;④CCl4、TiCl4二者能互溶,应该采用蒸馏方法分离,
所以答案是:蒸馏;⑤向物质的量之比为1:1的Ba( OH)2和NaOH的混合稀溶液中通入CO2 , 开始产生沉淀,故a点之前发生反应:CO2+Ba(OH)2=BaCO3↓+H2O,从图中可知:氢氧化钡、氢氧化钠消耗二氧化碳体积分别为5L、5L,所以a~b之间先后发生的反应为:2NaOH+CO2═Na2CO3、Na2CO3+H2O+CO2═2NaHCO3 , 总反应为:NaOH+CO2═NaHCO3 , 则b点溶液中溶质主要成分的化学式为NaHCO3 , b~c之间发生反应:BaCO3+H2O+CO2═Ba(HCO3)2 , 离子方程式为:BaCO3+H2O+CO2=Ba2++2HCO3﹣;
所以答案是:NaHCO3;BaCO3+H2O+CO2=Ba2++2HCO3﹣ .


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有四种物质:①氧化铝 ②稀硫酸 ③碳酸氢钠 ④氢氧化钠
(1)属于盐的物质是(填序号,下同).
(2)既能与强酸反应,又能与强碱反应的物质是 .
(3)分析铝与稀硫酸反应,i表示的内容为 . a.得到e﹣×6,化合价升高,被还原b.得到e﹣×6,化合价降低,被还原c.失去e﹣×6,化合价升高,被氧化.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关钠的叙述正确的是( )
A. 钠是银白色金属,硬度很大 B. 钠在空气中燃烧生成氧化钠
C. 金属钠的熔点很高 D. 金属钠可以保存在煤油中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA代表阿伏伽德罗常数,下列说法正确的是( )
A.常温常压32g O2 含2NA个原子
B.标准状况下11.2L H2O 含有的原子数目为1.5NA
C.1mol的Cl﹣ 含有NA个电子
D.0.5mol/L的NaCl 溶液中Cl﹣的个数为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.在加热、甲醛、饱和(NH4)2SO4溶液、X射线作用下,蛋白质都会发生变性
B.氨基酸、蛋白质、油脂都含有C、H、O、N四种元素
C.生活中食用的食醋、植物油、动物蛋白等物质都是混合物
D.可以用加热使蛋白质变性的方法分离提纯蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1molL﹣1稀盐酸.下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A.
B.
C.
D.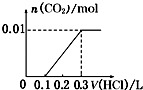
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用乙烯、甲苯、E三种原料合成高分子药物M和有机中间体L的路线如图: 
已知: 
Ⅲ.有机物L是一种六元环酯,M的分子式是(C15H16O6)n
(1)C中含氧官能团的名称 , D的结构简式
(2)E在KMO4/OH﹣中转化成F,F的结构简式 , H→J的反应类型 .
(3)H→L的化学反应方程式是 .
(4)K→M属于加聚反应,K的结构简式是 .
(5)写出一定量的C与足量NaOH溶液反应的化学方程式 .
(6)写出一种符合下列条件的C的同分异构体的结构简式 .
①属于芳香族化合物;
②能发生银镜反应;
③遇FeCl3溶液能发生显色反应
④核磁共振氢谱有4组峰,且峰面积之比为l:l:2:2.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于密闭容器中可逆反应A2(g)+3B2(g)═2AB3(g),探究单一条件改变情况下,可能引起平衡状态的改变,得到如图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是( ) 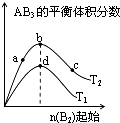
A.加入催化剂可以使状态d变为状态b
B.若T1>T2 , 则逆反应一定是放热反应
C.达到平衡时A2的转化率大小为:b>a>c
D.在T2和n(A2)不变时达到平衡,AB3的物质的量大小为:c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素,它们的单质及其化合物之间有很多转化关系,如表所列物质不能按如图关系(“→”表示一步完成)相互转化的是( )
选项 | A | B | C | D |
a | Na | Al | Fe | Cu |
b | NaOH | Al2O3 | FeCl3 | CuSO4 |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |

A.A
B.B
C.C
D.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com