
【题目】利用太阳能分解制氢气,若光解0.02 mol水,下列说法正确的是( )
A.可生成H2的质量为0.02g
B.可生成氢的原子数为2.408×1023个
C.可生成H2的体积为0.224L(标准状况)
D.生成H2的量理论上等于0.02mol 锌与盐酸反应产生H2的量
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:
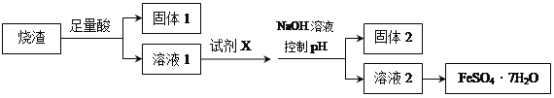
下列说法不正确的是( )
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图涉及的物质所含元素中,除一种元素外,其余均为1~18号元素。
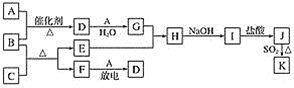
已知:A、F为无色气体单质,B为具有刺激性气味的气体,化学家哈伯因合成B获得1918年的诺贝尔化学奖。C为黑色氧化物,E为紫红色金属单质,I为蓝色沉淀(部分反应的产物未列出)。请回答下列问题:
(1)常温下铝遇到G的浓溶液后表面形成一层致密的保护膜,该现象称为___________。
(2)E与G的稀溶液反应的离子方程式为_________。
(3)在25 ℃和101 kPa的条件下,将VL的B气体溶于100 mL水中,得到密度为ρg·mL-1的溶液M,则M溶液的物质的量浓度为________ mol·L-1。(已知25 ℃、101 kPa条件下气体摩尔体积为24.5 L·mol-1,不必化简)
(4)分别蘸取B的浓溶液和G的浓溶液的玻璃棒,接近后的现象是_________。
(5)B和C反应的化学方程式为__________。
(6)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硅是一种重要的非金属材料,有科学家认为硅是“21世纪的能源”、“未来的石油”。
(1)工业上生产纯硅的工艺流程如下:
![]()
石英砂的主要成分是SiO2,在制备粗硅时,焦炭的作用是__________(填“氧化剂”或“还原剂”);在该反应中,若消耗了3.0 g SiO2 ,则转移电子的总数为_______________。
(2)某实验室利用SiHCl3(沸点33.0 ℃)与过量H2在1 000 ℃~1 100 ℃反应制得纯硅。已知SiHCl3能与H2O强烈反应,在空气中易自燃。装置如图所示(热源及夹持装置略去)。
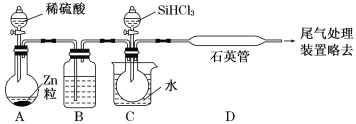
①装置B中的试剂是___________。装置C中的烧瓶需要加热,其目的是_________________。
②反应一段时间后,装置D中观察到的现象是______________________;装置D中发生反应的化学方程式为___________________________________。
③为检验产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需要加入的试剂有______(填字母)。
a.碘水 b.氯水 c.Na2SO3溶液 d.KSCN溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“垃圾是放错了位置的资源”,应该分类回收。某化学兴趣小组拟采用如下处理方法回收废电池中的资源。
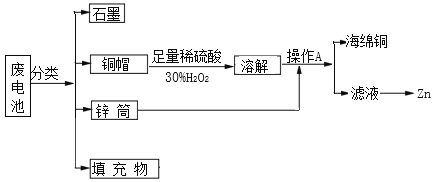
(1)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O═2MnOOH+ Zn(OH)2,其正极的电极反应式为_________。
(2)铜帽溶解时加入H2O2的目的是___________________ (用化学方程式表示)。铜帽溶解完全后,可采用________ 方法除去溶液中过量的H2O2。
(3)填充物中可以回收得到氯化铵,写出氯化铵溶液中各离子浓度的大小顺序______。
(4)铜器在潮湿环境中发生的电化学腐蚀如图所示:
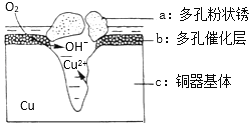
环境中的Cl﹣扩散到孔口,并与正极反应产物和负极产物作用生成多孔粉状锈Cu2(OH)3Cl,其若生成4.29g Cu2(OH)3Cl,则理论上消耗氧气体积为______L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物a(![]() )、b(
)、b(![]() )、c(
)、c(![]() )的说法正确的是
)的说法正确的是
A. a、b、c的分子式均为C8H8
B. a、b、c均能与溴水发生反应
C. a、b、c中只有a的所有原子会处于同一平面
D. a、b、c的一氯代物中,b有1种,a、c均有5种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学,回答下列问题并按要求填空:
(1)①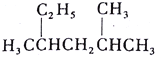 给此有机物予以命名________
给此有机物予以命名________
②![]() 的系统命名为:_____。
的系统命名为:_____。
③写出有机化合物的结构简式:3-乙基-2-戊醇 _____
(2)按要求完成下列反应化学方程式:
①CH3-CH2-Br 与氢氧化钠溶液在加热条件下的反应:____。
②乙醛与银氨溶液水浴加热条件下的反应:____。
③甲苯和硝酸合成炸药 TNT 的化学方程式:____;
④氯乙烯为单体合成塑料聚氯乙烯(PVC)的化学方程式:____;
⑤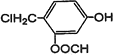 与 NaOH溶液在加热条件下的化学反应方程式________________。
与 NaOH溶液在加热条件下的化学反应方程式________________。
(3)下列括号内的物质为杂质,将除去下列各组混合物中杂质所需的试剂填写在横线上:
①乙酸乙酯(乙醇)_____;②甲苯(溴)_____;
(4)某有机化合物 A 的相对分子质量为 60,分子中含碳 40%,含氢 6.6%,其余为氧。
①通过计算确定该有机物的分子式_____;
②按中学常见官能团,写出两个其链状结构的有机物可能的结构简式:_____、_____。
(5)某有机物的结构简式为 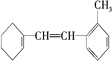 据此填写下列空格。
据此填写下列空格。
①该物质苯环上一氯代物有_____种;
②1mol 该物质和溴水混合,消耗 Br2 的物质的量为_____mol;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列模型并结合有关信息,判断下列说法不正确的是( )
晶体硼(其每个结构单元中有12个B原子) | NaCl | S8 | HCN | |
结构模型示意图 |
|
|
|
|
备注 | 熔点2573K | —— | 易溶于CS2 | —— |
A.晶体硼属于原子晶体,结构单元中含有30个B-B键,含20个正三角形
B.NaCl晶体中每个Na+周围距离最近且相等的Na+有6个
C.S8分子中的共价键为非极性键
D.HCN分子中含有2个σ键,2个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种兴奋剂的结构简式如图: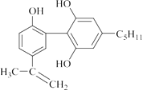 ,下列有关该物质的说法正确的是( )。
,下列有关该物质的说法正确的是( )。
A.1mol 该物质与浓溴水和H2 反应时,最多消耗 Br2 和H2 的物质的量分别为 4 mol、7 mol
B.该分子中所有碳原子可以稳定的共存在一个平面中
C.遇 FeCl3 溶液显紫色,因为该物质与苯酚属于同系物
D.滴入酸性 KMnO4 溶液,观察到紫色褪去,可证明分子中存在双键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com